Диаграмма состояние алюминиевых сплавов с кремнием. Обоснование выбора материала, его основные свойства
Короткий путь http://bibt.ru
ДИАГРАММА СОСТОЯНИЯ АЛЮМИНИЙ - КРЕМНИЙ. ДИАГРАММА СОСТОЯНИЯ.
ДИАГРАММА СОСТОЯНИЯ
диаграмма равновесия, фазовая диаграмма - графическое изображение соотношений между параметрами состояния физико-химической системы (температурой, давлением и др.) и ее составом. По диаграмме состояния можно установить, например, температуры начала и конца фазовых превращений, химический состав фаз. Диаграмма состояния широко используют в металловедении.
Иванов В. Н. Словарь-справочник по литейному производству. - М.: Машиностроение, 1990. - 384 с: ил. ISBN 5-217-00241-7 , 1990 .
ДИАГРАММА СОСТОЯНИЯ АЛЮМИНИЙ - КРЕМНИЙ
диаграмма, показывающая фазовый состав и структуру сплавов с различным содержанием Аl и Si (рис. Д-4). Si не образует химических соединений с Аl. Растворимость Аl в Si очень мала; поэтому можно считать, что в системе Al - Si присутствует чистый Si. Растворимость Si в Аl при эвтектической температуре равна 1,65%, при нормальной - около 0,05%. Эвтектика содержит 11,7% Si и состоит из твердого раствора α и Si.
Рис. Д-4. Диаграмма состояния алюминий - кремний
Вопрос 1. Вычертите диаграмму состояния системы алюминий-медь. Опишите взаимодействие компонентов в жидком и твердом состояниях, укажите структурные составляющие во всех областях диаграммы состояния и объясните характер изменения свойств сплавов в данной системе с помощью правил Курнакова.
Наиболее важной примесью в дуралюмине является медь.
Диаграмма состояния сплавов А1-Си (рис.1.) относится к диаграммам состояния III типа, когда компоненты образуют твер-дый раствор с
ограниченной растворимостью, уменьшающейся с по-нижением температуры. В сплавах, имеющих диаграмму состояния такого типа, протекает вторичная
кристаллизация, связанная с ча-стичным распадом твердого раствора. Такие сплавы можно под-вергать термической обработке III и IV групп, т. е. закалке
Диаграмма состояния сплавов алюминий - медь.
и ста-рению.Из диаграммы состояния А1 - Си следует, что наибольшая рас-творимость меди в алюминии наблюдается при 548°, когда она составляет
5,7%; при понижении температуры растворимость меди в алю-минии уменьшается и при комнатной температуре составляет 0,5%. Если сплавы с содержанием меди от 0,5 и до 5,7% подвергнуть за-калке с нагревом выше температур фазовых превращений (например, выше точки 5 на диаграмме состояния сплавов А1 - Си), то сплав перейдет в однородный твердый раствор а. После закалки в сплаве будет протекать распад твердого раствора, сопровождающийся выделением избыточной фазы высокой степени дисперсности. Такой фазой в сплавах А1 - Си, является твердое и хрупкое хими-ческое соединение СиА1 2 .
Распад пересыщенного твердого раствора может протекать в течение длительного времени при вылеживании сплава при ком-натной температуре (естественное старение) и более быстро при повышенной температуре (искусственное старение). В результате старения твердость и прочность сплава повышаются, а пластич-ность и вязкость снижаются.
Согласно теории старения , наиболее полно разработанной с помощью правил Курнакова, процесс старения в сплавах протекает в несколько стадий. Упрочнение сплавов, наблюдающееся в результате старения, соответствует периоду выделения избыточных фаз в высокодисперсном состоянии. Происходящие в структуре изменения можно наблюдать только при помощи электронного микроскопа . Обычно эта стадия процесса протекает у закаленных сплавов при естественном старении. При этом твердость и прочность сплава повышаются.
При нагреве закаленных сплавов до сравнительно низких температур, разных для различных сплавов (искусственное старе-ние), протекает вторая стадия, состоящая в укрупнении частиц выделившихся фаз. Этот процесс можно наблюдать при помощи оптического микроскопа. Появление в микроструктуре укрупнен-ных выделений фаз-упрочнителей совпадает с новым изменением свойств - снижением прочности и твердости сплава и повышением его пластичности и вязкости. Старение наблюдается только у спла-вов, которые имеют диаграмму состояния с ограниченной растворимо-стью, уменьшающейся с понижением температуры. Так как большое количество сплавов имеет диаграмму этого типа, то явление старе-ния весьма распространено. На явлении старения основана термиче-ская обработка многих цветных сплавов - алюминиевых, медных и др.
В рассмотренных выше сплавах А1 - Си этот процесс протекает следующим образом. При естественном старении в закаленном сплаве происходит образование зон (дисков) с повышенным содер-жанием меди. Толщина этих зон, называемых зонами Гинье - Престона, равна двум-трем атомным слоям. При нагреве до 100° и выше эти зоны превращаются в так называемую Ө - фазу, являю-щуюся неустойчивой аллотропической модификацией химического соединения СиА1 2 . При температуре выше 250° фаза 9" превращается в фазу Ө (СиА1 2). Дальше происходит укрупнение выделений фазы Ө (СиА1 2). Наибольшую твердость и прочность имеет сплав в первой стадии старения.
В дуралюмине марки Д1 в процессе распада твердого раствора выделяется также фаза Ө, а в дуралюмине марки Д16 таких фаз несколько.
Технология термической обработки деталей из дуралюмина состоит из закалки, проводимой с целью получения пересыщенного твердого раствора, и естественного или искусственного старения. Для закалки детали нагревают до 495° и охлаждают в холодной воде.
Закаленные детали подвергают естественному старению путем выдерживания их при комнатной температуре. После 4-7 суток вылеживания детали приобретают наиболее высо-кую прочность и твердость. Так, предел прочности дуралюмина марки Д1, находящегося в отожженном состоянии, составляет 25 кг/мм 2 , а твердость его равна Н В = 45; после закалки и естест-венного старения предел прочности равен 40 кг/мм 2 , а твердость повышается до Н в = 100.
Время, необходимое для распада твердого раствора, может быть сокращено до нескольких часов путем нагрева закаленного дуралюмина до 100 - 150 ◦ (искусственное старение), однако значения твердости и прочности при искусственном старении несколько ниже, чем при естественном. Несколько снижае5тся и коррозионная устойчивость . Наиболее высокую твердость и прочность после закалки и старения имеют дуралюмины марок Д16 и Д6.Дуралюмины марок ДЗП и Д18 являются сплавами с повышенной пластичностью.
Дуралюмины получили широкое применение в различных отраслях промышленности, особенно в авиастроении, вследствие малого удельного веса и высоких механических свойств после термической обработки.
При маркировке дуралюмининов буква Д обозначает «дуралюмин», А цифра - условный номер сплава.
2. ДИАГРАММА СОСТОЯНИЯ ЖЕЛЕЗОУГЛЕРОДИСТЫХ СПЛАВОВ
Сплавы железа с углеродом условно относят к двухкомпонентным сплавам. В их составе, кроме основных компонентов - железа и углерода , содержатся в небольших количествах обычные примеси- марганец , кремний , сера , фосфор , а также газы - азот , кислород , водород и иногда следы некоторых других элементов. Железо с углеродом образует устойчивое химическое соединение Fe 3 C (93,33% Fe и 6,67% С), называемое кар-бидом железа или цементитом. В применяемых сплавах железа с углеродом (сталях, чугунах) содержание углерода не превышает 6,67%, и поэтому практическое значение имеют сплавы железа с кар-бидом железа (система Fe -Fe 3 C ), в которых вторым компонентом является цементит.
При содержании углерода выше 6,67% в сплавах не будет сво-бодного железа, так как оно все войдет в химическое соединение с углеродом. В этом случае компонентами сплавов будут являться карбид железа и углерод ; сплавы будут относиться ко второй системе Fe 3 C -С, которая исследована недостаточно. Кроме того , железо-углеродистые сплавы с содержанием углерода выше 6,67% обладают большой хрупкостью и практически не применяются.
Сплавы Fe -Fe 3 C (с содержанием С до 6,67%), наоборот, имеют большое практическое значение. На рис. 2 приведена структурная диаграмма состояния сплавов Fe -Fe 3 C , построенная в координатах температура - концентрация. По оси ординат отложены темпера-туры нагрева сплавов, а по оси абсцисс - концентрация углерода в процентах. Левая ордината соответствует 100% содержанию железа, а правая ордината-содержанию углерода 6,67% (или 100%-ной концентрации Fe 3 C ).
На правой ординате отложена температура плавления Fe 3 C , соответствующая 1550° (точка D на диаграмме).
В связи с тем что железо имеет модификации, на левой ординате, кроме температуры плавления железа 1535° (точка А на диаграмме), отложены также температуры аллотропических превращений же-леза: 1390° (точка N ) и 910° (точка G ).
Таким образом, ординаты диаграммы соответствуют чистым компо-нентам сплава (железо и цементит), а между ними располагаются точ-ки, соответствующие сплавам разной концентрации от 0 до 6,67% С
Рис. 2. Структурная диаграмма состояния сплавов Fe - Fe 3 C .
В определенных условиях химическое соединение (цементит) может не образоваться , что зависит от содержания кремния, мар-ганца и других элементов, а также от скорости охлаждения слитков или отливок. При этом углерод выделяется в сплавах в свободном состоянии в виде графита. Двух систем сплавов (Fe -Fe 3 C и Fe 3 C -С) в этом случае не будет. Они заменяются одной системой сплавов Fe -С, не имеющей химических соединений.
2.1 Структурные составляющие железоуглеродистых сплавов.
Микро-скопический анализ показывает, что в железоуглеродистых сплавах образуется шесть структурных составляющих, а именно: феррит, цементит, аустенит и графит, а также перлит и ледебурит.
Ферритом называют твердый раствор внедрения углерода в Fe a . Так как растворимость углерода в Fe « незначительна, то феррит можно считать практически чистым Fe a . Феррит имеет объемно-центрированную кубическую решетку (Кб). Под микроско-пом эта структурная составляющая имеет вид светлых зерен раз-личной величины. Свойства феррита одинаковы со свойствами железа: он мягок и пластичен, предел прочности 25 кг/мм 2 , твердость Н В = 80, относительное удлинение 50%. Пластичность феррита зависит от величины его зерна: чем мельче зерна, тем пластичность его выше. До 768° (точка Кюри) он ферримагнитен, а выше - пара-магнитен.
Цементитом называют карбид железа Fe 3 C . Цементит имеет сложную ромбическую решетку. Под микроскопом эта структурная составляющая имеет вид пластинок или зерен раз-личной величины. Цементит тверд (Н В > 800 ед.) и хрупок, а от-носительное удлинение его близко к нулю. Различают цементит, выде-ляющийся при первичной кристаллизации из жидкого сплава (пер-вичный цементит или Ц 1), и цементит, выделяющийся из твердого раствора Y -аустенита (вторичный цементит или Ц 2). Кроме того, при распаде твердого раствора а (область GPQ на диаграмме состояния) выделяется цементит, называемый в отличие от предыдущих третичным цементитом или Ц 3 . Все формы цементита имеют одинаковое кристаллическое строение и свойства, но различную величину частиц - пластинок или зерен. Наиболее крупными являются частицы первичного цементита, а наиболее мелкими частицы первичного цементита. До 210° (точка Кюри) цементит ферримагнитен, а выше ее - парамагнитен.
Аустенитом называют твердый раствор внедрения углерода в Fe Y . Аустенит имеет гранецентрированную кубическую решетку (К12). Под микроскопом эта структурная составляющая имеет вид светлых зерен с характерными двойными линиями (двой-никами). Твердость аустенита равна Н В = 220. Аустенит парамаг-нитен.
Графит имеет неплотноупакованную гексагональную решетку со слоистым расположением атомов. Под микроскопом эта структурная составляющая имеет вид пластинок различной формы и величины в серых чугунах, хлопьевидную форму в ковких чугунах, шарообразную форму в высокопрочных чугунах. Механические свойства графита чрезвычайно низки.
Все перечисленные четыре структурные составляющие одновре-менно являются также фазами системы сплавов железа с углеродом, так как они однородны - твердые растворы (феррит и аустенит), химическое соединение (цементит) или элементарное вещество (гра-фит).
Структурные составляющие ледебурит и перлит не однородны. Они представляют собой механические смеси, обладающие особыми свойствами (эвтектику и эвтектоид).
Перлитом называют эвтектоидную смесь феррита и цементита. Он образуется из аустенита при вторичной кристалли-зации и содержит 0,8% С. Температура образования перлита 723°. Эту критическую температуру, наблюдаемую только у стали, назы-вают точкой А±. Перлит может иметь пластинчатое строение, если цементит имеет форму пластинок, или зернистое, когда цементит имеет форму зерен. Механические свойства пластинчатого и зерни-стого перлита несколько отличаются. Пластинчатый перлит имеет предел прочности 82 кг/мм 2 , относительное удлинение 15%, твер-дость Н в = 190-^-230. Предел прочности зернистого перлита равен 63 кг/мм 2 , относительное удлинение 20% и твердость Я» = = 1.60-г- 190.
Ледебуритом называют эвтектическую смесь аусте-нита и цементита. Он образуется в процессе первичной кристалли-зации при 1130°. Это наиболее низкая температура кристаллизации в системе сплавов железа с углеродом. Аустенит, входящий в состав ледебурита, при 723° превращается в перлит. Поэтому ниже 723° и вплоть до комнатной температуры ледебурит состоит из смеси перлита и цементита. Он очень тверд (Н в ^ 700) и хрупок. Наличие ледебурита является структурным признаком белых чугунов. Механические свойства железоуглеродистых сплавов изме-няются в зависимости от количества структурных составляющих, их формы, величины и расположения.
Структурная диаграмма состояния Fe -Fe 3 C является сложной диаграммой, так как в сплавах железо - углерод происходят не только превращения , связанные с кристаллизацией, но и превра-щения в твердом состоянии.
Границей между сталями и белыми чугунами является концентрация углерода 2%, а структурным признаком - наличие или отсут-ствие ледебурита. Сплавы с содержанием углерода менее 2% (у кото-рых ледебурита нет) называют сталями, а с содержанием углерода свыше 2% (в структуре которых есть ледебурит) - белыми чугунами.
В зависимости от концентрации углерода и структуры стали я чугуны принято подразделять на следующие структурные группы: доэвтектоидные стали (до 0,8% С); структура - феррит и перлит; эвтектоидная сталь (0,8% С); структура - перлит;
заэвтектоидные стали (свыше 0,8 до 2% С); структура - перлит в вторичный цементит;
доэвтектические белые чугуны (свыше 2 до 4,3% С); структура - ледебурит (распавшийся), перлит и вторичный цементит;
эвтектический белый чугун (4,3% С); структура-ледебурит;
заэвтектические белые чугуны (свыше 4,3 до 6,67% С); структура- ледебурит (распавшийся) и первичный цементит.
Это подразделение, как видно из диаграммы состояния Fe -Fe 3 C , соответствует структурному состоянию этих сплавов, наблюдаемому при комнатной температуре.
Вопрос 3.
Выберите инструментальный твердый сплав для чистового фрезерования поверхности детали из стали 30ХГСА. Дайте характеристику, расшифруйте выбранную марку сплава, опишите особенности структуры и свойства сплава.
Инструменты подразделяются на три группы: режущие (резцы, сверла, фрезы и др.), измерительные (калибры, кольца , плитки и др.), и инструменты для горячей и холодной обработки металлов давлением (штампы, волочильные доски и др.). В зависимости от вида инструментов требования, предъявляемые к сталям для их изготовления, разные.
Основным требованием, предъявляемым к сталям для режущих инструментов, является наличие высокой твердости, не снижающейся при высоких температурах, возникающих в процессе обработки металлов резанием (красностойкости). Твердость для металлорежущих инструментов должна составлять R c = 60÷65. Кроме того, стали для режущих инструментов должны обладать высокой износоустойчивостью, прочностью и удовлетворительной вязкостью.
Наибольшее применение для изготовления режущих инструментов получили быстрорежущие стали. Быстрорежущая сталь является многокомпонентным сплавом и относится к карбидному (ледебуритному) классу сталей. В ее состав, кроме железа и углерода, входят хром , вольфрам и ванадий . Основным легирующим элементом в быстрорежущей стали является вольфрам. Наибольшее распространение получили (табл. 3) марки быстрорежущей стали Р18 (18 % W ) и Р9 (9 % W ).
Высокую твердость R C = 62 и красностойкость быстрорежущая сталь приобретает после термической обработки, состоящей из закалки и многократного отпуска.
Таблица 1
Химический состав быстрорежущей стали
(по ГОСТ 5952-51)
| Марка стали | |||||
| C | W | Cr | V | Mo |
|
| Р 18 | 0,70 – 0,80 | 17,5 – 19,0 | 3,8 – 4,4 | 1,04 – 1,4 | ≤0,3 |
| Р 9 | 0,85 – 0,95 | 8,5 – 10,0 | 3,8 – 4,4 | 2,0 – 2,6 | ≤0,3 |
На рис.3 приведен график термической обработки быстрорежущей стали Р18.
Мы выбираем ее в качестве инструментального твердого сплава для чистого фрезерования т.к. эта марка стали подходит нам по своим характеристикам.
Термическая обработка быстрорежущей стали имеет ряд особенностей, которые обусловли-ваются ее химическим составом. Нагрев быстрорежущей стали, при закалке производится до высокой температуры (1260-1280°), необхо-димой для того, чтобы растворить в аустените карбиды хрома, воль-фрама и ванадия. До 800-850° нагрев производится медленно, чтобы избежать больших внутренних напряжений в стали вследствие ее малой тепло-проводности и хрупкости, затем производят быстрый нагрев до 1260-.1280° с целью избежания роста зерна аустенита и обезуглерожива-ния. Охлаждение быстрорежущей стали производится в масле. Широкое применение получила также ступенчатая закалка быстро-режущей стали в солях при температуре 500-550°.
Структура быстрорежущей стали после закалки состоит из мар-тенсита (54%), карбидов (16%) и остаточного аустенита (30%). После закалки быстрорежущая сталь подвергается многократному отпуску при 560°. Обычно производят трехкратный отпуск с выдержкой по 1 часу для того, чтобы уменьшить количество остаточного аустенита и повысить твердость стали. Во время вы-держки при температуре отпуска из аустенита выделяются карбиды, а при охлаждении аустенит превращается в мартенсит. Происходит как бы вторичная закалка. Структура быстрорежущей стали после отпуска - мартенсит отпуска, высокодисперсные карбиды и неболь-шое количество остаточного аустенита. Для еще боль-шего снижения количества остаточного аустенита быстрорежущие стали подвергают обработке холодом, которая производится перед отпуском. Весьма эффективно для повышения твердости и износо-стойкости применение низкотемпературного цианирования.
Быстрорежущие стали получили широкое распространение для изготовления различных режущих инструментов; изготовленные из этих сталей инструменты работают со скоростями резания, в 3-4 раза превышающими скорости резания инструментов из углеродистых сталей, и сохраняют режущие свойства при нагреве в процессе резания до 600 º - 620 º .
Вопрос. 4 Выберите наиболее рациональную и экономичную марку стали для изготовления пружины, которая после термической обработки должна получить высокую упругость и твердость не менее 44 …45 НRC Э. Дайте характеристику, укажите состав стали, выберите и обоснуйте режим термообработки. Опишите и зарисуйте микроструктуру и свойства стали после термообработки.
Пружины используют для накопления энергии (пружинные моторчики), для восприятия и амортизации ударов, для компенсации теплового расширения в механизмах клапанного распределения и пр. Деформация пружины может проявляться в форме ее растяжения, сжатия, изгиба или скручивания.
Зависимость между силой Р и деформацией пружины F называется характеристикой пружины.
Согласно справочника конструктора – машиностроения, авт. Анурьев. В.И., выбираем наиболее рациональную и экономичную марку стали:
Сталь – 65Г (марганцевая сталь), имеющую упругость и твердость равную 42…48 HRC Э. по Реквелю. Термическая обработка стали : температура закалки - 830 º С, (среда масло.), отпуск - 480 º С. Предел прочности (δ В) – 100 кг/мм 2 , предел текучести (δ т) – 85 кг/мм 2 , относительное удлинение (δ 5) – 7%, относительное сужение (ψ) – 25%.
Характеристика – ресорно-пружинная сталь, высокого качества с содержанием P – S не более 0,025%. Подразделяется на 2 – категории: 1 – обезуглероженного слоя, 2 – с нормированным обезуглероженным слоем
Вопрос 5. Для изготовления дисков компрессора авиадвигателя применили сплав АК4-1. Дайте характеристику, укажите состав и характеристику механических свойств сплава, способ и природу упрочнения сплава, способы защиты от коррозии.
АК4-1 – сплав на основе алюминия, перерабатываемый в изделие методом деформирования, упрочняемый термической обработкой , жаропрочный.
Состав сплава: Mg – 1.4…1.8%. Cu – 1.9…2.5%. Fe – 0.8…1.3%. Ni – 0.8…1.3%. Ti – 0.02…0.1%, примеси до 0,83%. Предел прочности сплава 430 МПа, предел текучести 0,2 – 280 МПа.
Легирован железом , никелем, медью, и др. элементами образующими упрочняющие фазы
Вопрос 6. Экономические предпосылки применения неметаллических материалов в промышленности. Опишите группы, свойства газонаполненных пластмасс, приведите примеры из каждой группы, их свойства и область применения в конструкциях летательных аппаратов.
В последнее время все более широкое применение в качестве конструкционных материалов находят неметаллические полимерные материалы . Главная особенность полимеров заключается в том, что они обладают рядом свойств не присущих металлам , и могут служить хорошим дополнением к металлическим конструкционным материалам либо быть их заменой, а многообразие физико-химических и механических свойств, присущих различным видам пластмасс, и простота переработки в изделия обуславливают широкое применение во всех отраслях машиностроения, приборостроения, аппаратостроения и быту. Пластические массы отличаются малым удельным весом (от 0,05 до 2,0 г/см 3 ), обладают высо-кими изоляционными свойствами, хорошо противостоят коррозии, отличаются широким диапазоном коэффициента трения и высоким сопротивлением истиранию.
В случае необходимости получения изделий, обладающих анти-коррозийной стойкостью, кислотоупорностью, бесшумностью в ра-боте с одновременным обеспечением легкости конструкции пласти-ческие массы могут служить заменителями черных металлов. Бла-годаря прозрачности и высоким пластическим свойствам некоторых видов пластмасс их широко применяют для изготовления небьюще-гося стекла для автомобильной промышленности. При изготовлении изделий с высокими электроизоляционными свойствами пластмассы заменяют и вытесняют высоковольтный фарфор, слюду, эбонит и прочие материалы. Наконец, паро-, бензо- и газопроницаемость, а также высокая водо- и светостойкость при хорошем внешнем виде обеспечивают широкое применение пластмасс в ряде отраслей про-мышленности.
Из пластмасс изготовляют вкладыши для подшипников, сепара-торы, бесшумные зубчатые колеса , лопасти вентиляторов, лопатки для моечных машин и мешалок, радиоаппаратуру, футляры для радио-приемников и часов, электрическую аппаратуру, дистрибуторы, шлифовальные круги, непромокаемые и декоративные ткани и разно-образные предметы широкого потребления.
Пенопласты представляют собой легкие газонаполненные пластические массы на основе синтетических смол. Пенопласты подразделяются на две группы: 1 – материалы с сообщающимися порами – губки (плотность менее 300 кг/м 3), 2 – материалы с изолированными порами – пены (плотностью более 300кг/м 3).
Свойства пенопластов очень разнообразны: одни обладают твердостью, как стекло , другие – эластичностью, подобно резине. Все пенопласты хорошо поддаются механической обработке столярным инструментом, легко прессуются в нагретом состоянии в изделия сложной формы и склеиваются. В авиастроении пенопласты применяют в качестве заполнителя между двумя обшивками в целях повышения жесткости и прочности конструкции, а также как тепло – и звукоизоляционный материал.
Диаграмма состояния медь - алюминий построена во всем интервале концентраций методами термического, металлографического, рентгеновского анализов и представляет собой сложную диаграмму с промежуточными фазами. Диаграмма состояния медь - алюминий (рис. 1) приводится на основе работ, выполненных различными авторами на протяжении длительного времени . Область твердых растворов на основе меди (α-фаза) простирается до 9% (по массе) Al. С понижением температуры растворимость алюминия в меди повышается и при температурах 1037; 900; 800; 700; 500 °С составляет 7,4; 7,8; 8,2; 8,8; 9,4% (по массе) Al соответственно. Фаза а имеет ГЦК решетку, аналогичную решетке чистой меди, период которой увеличивается с повышением содержания алюминия и в сплаве с 10,5% (по массе) Al составляет 0,3657 нм.
Фаза β представляет собой твердый раствор на основе соединения Cu 3 Al . В сплавах β-области в зависимости от термообработки и условий охлаждения могут наблюдаться две метастабильные промежуточные фазы: β" и β.
Фаза γ 1 -твердый раствор на основе соединения Cu 3 Al 4 существует в интервале концентраций 16,0...18,8% (по массе) Al и имеет моноклинную решетку со 102 атомами в элементарной ячейке. Фаза α 2 имеет решетку, подобную решетке α-фазы.
В области до 20% (по массе) Al ликвидус сплавов состоит из четырех ветвей первичной кристаллизации фаз α, β, χ и χ 1 . При 1037 С кристаллизуется эвтектика α + β с эвтектической точкой при 8,5% (по массе) Al. При температурах 1036 и 1022 °С протекают перитектические реакции Ж + β ↔χ и Ж + χ↔γ 1 . соответственно. Фаза χ существует в температурном интервале 1036...936 °С. Фаза β кристаллизуется из расплава по кривой с максимумом при температуре 1048 °С и соответствует концентрации 12,4% (по массе) Al. В твердом состоянии в этой области имеется ряд эвтектоидных и перитектоидных превращений. При 963 °С фаза χ распадается на β- и γ 1 -фазы. Эвтектоидная точка соответствует 15,4% (по массе) Al. При 780 °С γ 1 -фаза распадается по эвтектоидной реакции на β и γ 2 -фазы. При 873 °С по перитектощцюй реакции образуется γ-фаза. Предполагается, что в γ 2 -фазе происходит фазовое превращение в интервале температур 400...700 °С при содержании алюминия в эвтектоидной точке 11,8...11,9% (по массе). В области концентрации 9...16% (по массе) Al предполагается существование еще одной стабильной фазы - χ или α 2 , образующейся по эвтектоидной реакции при 363 °С и содержании алюминия в эвтектоидной точке ∼11,2% (по массе). Концентрационные пределы области гомогенности этой фазы не установлены.
Авторы на основе литературных данных по термодинамическим свойствам компонентов и промежуточных фаз, а также на основе экспериментальных данных по фазовым равновесиям рассчитали диаграмму состояния системы Cu-Al. Значения рассчитанных температур фазовых превращений практически совпадают с данными работы .
Медь - бериллий
Диаграмму состояния медь - бериллий изучали многие исследователи. Она построена во всем интервале концентраций (рис. 2). Кривые кристаллизации сплавов состоят из четырех ветвей, соответствующих кристаллизации фаз α, β, δ и β-Ве. β-фаза кристаллизуется по кривой с минимумом при температуре 860 °С и 5,3% (по массе) Be. При 870 °С образуется β-фаза по перитектической реакции, а при 578 °С β-фаза распадается по эвтектоидной реакции. Имеются данные о более высокой температуре эвтектоидного превращения - 605 °С.

Растворимость бериллия в меди при температуре эвтектоидного превращения составляет 1,4% (по массе). С понижением температуры растворимость бериллия уменьшается и составляет: при 500 °С - 1,0% (по массе) , при 400 °С - 0,4% (по массе) , при 300 °С - 0,2% (по массе) . В интервале концентраций 50,8...64,3% (ат.) Be при 930 °С протекает перитектическая реакция образования β"-фазы, а при 1090 °С имеет место эвтектоидное превращение β ↔α-Ве +δ . Границы фазовых областей δ/δ + α-Ве и δ + α-Ве/α-Ве проходят при 1000 °С через 81,5 и 92,5% (ат.) Be, при 900 °С - 81,0 и 93,0% (ат.) Be, при 700 °С - 80,8 и 95,5% (ат.) Be соответственно.
Фаза δ образуется по перитектической реакции при температуре 1239 °С. Твердый раствор на основе меди (α-фаза) имеет ГЦК решетку с периодом α = 0,3638 нм при 2,1% (по массе) Be, δ-фаза имеет неупорядоченную ОЦК решетку с периодом α = 0,279 нм при 7,2% (по массе) Be, β′-фаза имеет упорядоченную объемно центрированную кубическую решетку типа CsCl с периодом α = 0,269...0,270 нм, δ-фаза имеет кубическую решетку типа MgCu 2 с периодом α = 0,5952 нм. Фаза β-Ве - высокотемпературная, а α-Ве - низкотемпературная модификация твердого раствора на основе бериллия.
По данным , где приведена часть диаграммы до 50% (ат.) Cu, δ-фаза (Ве 4 Cu-Ве 2 Cu) плавится конгруэнтно при 1219 °С и 22% (ат.) Cu. β-фаза имеет структуру типа MgCu 2 и меняет период решетки в области гомогенности от α = 5957 нм до α = 0,5977 нм при 25% (ат.) Cu.
Медь - железо
Диаграмму состояния медь - железо изучали многие исследователи. Результаты этих исследований подробно анализируются в работах . Основные противоречия относятся к вопросу о полной или частичной смешиваемости меди и железа в жидком состоянии. В результате экспериментов было установлено, что в системе медь - железо отсутствует расслоение, однако для переохлажденного состояния (100 °С) расслоение имеет место. Область расслоения почти симметрична оси, соответствующей эквиатомному составу, а критическая температура смешивания лежит на 20 °С ниже температуры ликвидуса при эквиатомном составе.
На рис. 3 приведена диаграмма состояния медь - железо по данным . Установлены два перитектических и одно эвтектоидное превращения при температурах 1480; 1094 и 850 °С. Растворимость железа в меди при 1025; 900; 800 и 700 °С составляет 2,5; 1,5; 0,9; 0,5% (по массе) Fe соответственно. Период решетки твердого раствора на основе меди для сплава с 2,39% (ат.) Fe составляет 0,3609 нм. Период решетки α-Fe (ОЦК) возрастает с 0,28662±0,00002 до 0,28682 нм при добавлении 0,38% (ат.) Cu.

Медь - кобальт
Диаграмма состояния системы медь - кобальт приведена на рис. 4 . Она хорошо согласуется с результатами более ранних исследований этой диаграммы. В этой системе в результате переохлаждения на 100 °С и более появляется область несмешиваемости в жидком состоянии, которая почти симметрична относительно оси, отвечающей эквиатомному составу. При этом составе критическая температура смешения лежит на 90 °С ниже кривой ликвидус.

Система Cu-Со - перитектического типа. Температура перитектической реакции 1112 °С. Данные о растворимости кобальта в твердом растворе на основе меди (β) и меди в твердом растворе на основе кобальта (а) в интервале температур 900... 1100 °С приведены в табл. 1.

Медь - кремний
Диаграмма состояния медь - кремний приведена на рис. 5 (по совокупности работ). В системе существуют α-твердый раствор на основе меди, β-, δ-, η-фазы, а также К-, γ- и ε-фазы, образующиеся по перитектоидным реакциям.

Область существования β-фазы [ОЦК решетка с α = 0,2854 нм при 14,9% (ат.) Si] находится в интервале температур 852...785 °С; она образуется по перитектической реакции с точкой перитектического превращения 6,8% (по массе) Si. Область существования β-фазы охватывает интервал температур 824...710 °С и образуется по перитектической реакции; точка перитектического превращения 8,65% (по массе) Si. Фаза η имеет две модификации: η′ и η″. В интервале температур 620... 558 °С имеет место превращение η↔η′ а в интервале 570...467 °С - превращение η′↔η″. Решетка η-фазы подобна решетке γ-латуни.
Фаза К образуется по перитектоидной реакции при +842 °С и существует до 552 °С, точка перитектоида соответствует 5,9% (по массе) Si. K-фаза имеет плотноупакованную гексагональную решетку с α = 0,25543 нм и с = 0,41762 нм при 11,8% (ат.) Si и α = 0,25563 нм и с = 0,41741 нм при 14,6% (ат.) Si. Фаза γ образуется по перитектоидной реакции при 729 °С и стабильна до комнатной температуры; перитектоидная точка соответствует 8,35% (по массе) Si.
Фаза γ имеет кубическую решетку типа решетки β-Mn с периодом α = 0,621 нм.
Фаза ε образуется также по перитектоидной реакции при 800 °С и существует в узкой концентрационной области 10,6... 10,7% (по массе) Si, стабильна до комнатной температуры. Она имеет ОЦК решетку с α = 0,9694 нм. Растворимость меди в кремнии ничтожно мала и составляет 2,810 -3 ; 2·10 -3 ; 5,5·10 -4 ; 8,5·10 -5 ; 5,3·10 -6 % (ат.) при температурах 1300; 1200; 1000; 800 и 500 °С соответственно. Растворимость кремния в меди значительна и составляет ∼5,3% (по массе) при 842 °С.
Медь - марганец
Диаграмма состояния системы медь - марганец построена во всем интервале концентраций. Здесь она приведена по данным (рис. 6). Медь и марганец образуют на кривой ликвидус минимум при содержании ∼37% (ат.) Mn и температуре 870±5 °С. Превращения в твердом состоянии связаны с процессами упорядочения в сплавах со стороны меди и аллотропическими модификациями марганца. Твердый раствор (α-Cu, γ-Mn) упорядочивается при ∼16% (ат.) Mn (МnCu 5) и 400 °С и при ∼25% (ат.) Mn (MnCu 3) и 450 °С.

Растворимость меди в α-Mn и β-Mn фазах незначительна. В системе имеет место непрерывный переход от гранецентриро-ванной кубической решетки твердого раствора на основе меди (α-Cu) в гранецентрированную тетрагональную решетку γ-Mn.
Медь - никель
Диаграмма состояния системы медь - никель представляет собой систему с непрерывным рядом твердых растворов. На рис.7 приведены результаты хорошо согласующихся между собой экспериментальных исследований. В твердом состоянии имеются превращения, связанные с магнитными превращениями в никеле. Все сплавы системы Cu-Ni имеют ГЦК решетку. Предположения о существовании в системе соединений CuNi и CuNi 3 в более поздних работах не подтвердились . Сплавы этой системы являются основой промышленных сплавов типа мельхиор.

Медь - олово
На рис. 8 приведена диаграмма состояния, построенная на основе большого количества работ . В системе установлено существование ряда фаз, образующихся как при первичной кристаллизации, так и при превращении в твердом состоянии. Фазы α, β, γ, ε, η образуются при первичной кристаллизации, фазы ζ и δ - в твердом состоянии. Фазы β, γ и η образуются по перитектическим реакциям при температурах 798, 755 и 415 °С. Период решетки α-фазы увеличивается от 0,3672 до 0,3707 нм. Фазы β и γ кристаллографически подобны и имеет ОЦК решетку.

Фаза ε существует на основе соединения Cu 3 Sn и имеет ромбическую решетку. η-фаза соответствует соединению Cu 6 Sn 5 . Она упорядочивается при 189...186 °С. Фаза ζ имеет гексагональную решетку предполагаемого состава Cu 20 Sn 6 . δ-фаза имеет структуру γ-латуни, она является электронным соединением и соответствует формуле Cu 31 Sn 8 при 20,6% (ат.) Sn.
Растворимость олова в меди, по данным рентгеноспектрального анализа, составляет, % (ат.) Sn [% (по массе) - в круглых скобках]: 6,7 (11,9); 6,5 (11,4); 5,7 (10,10) при температурах 350; 250; 150 °С соответственно. Растворимость меди в олове в твердом состоянии при эвтектической температуре составляет 0,01% (ат.) (по данным Токсеитова и др.).
Медь - свинец
Диаграмма состояния медь - свинец, построенная во всем интервале концентраций, приведена на рис. 9 по данным работы . Диаграмма состояния системы медь - свинец характеризуется наличием монотектического и эвтектического превращений. Температура монотектического превращения (955±0,5) С, а протяженность области несмешиваемости при этой температуре составляет 15,7-63,8% (ат.) Рb. Эвтектическая точка соответствует 0,18% (ат.) Рb, а по данным - температуре 326 °С и 0,2% (ат.) Рb. Кривая растворимости между монотектической температурой и температурой плавления свинца определена довольно тщательно. Установлено, что эта кривая пересекает монотектическую горизонталь при содержании свинца 67% (ат.) . Растворимость свинца в меди в твердом состоянии при температуре выше 600 °С не более 0,09% (ат.) . Растворимость меди в свинце в твердом состоянии составляет менее 0,007% (по массе).

Медь - сурьма
Диаграмма состояния медь - сурьма представлена по данным на рис. 10.

В сплавах этой системы обнаружена высокотемпературная β-фаза с ГЦК решеткой типа BiF 3 , которая плавится конгруэнтно при 684 °С и содержании в сплаве 28,6% (ат.) Sb. При 435 °С β-фаза эвтектоидно распадается на фазу к и Cu 2 Sb. Эвтектоидная точка отвечает 24% (ат.) Sb. Максимальная растворимость β-фазы 20...32%) (ат.) Sb. Другие промежуточные фазы - η, ε, ε′ и к-образуются по перитектоидным реакциям при температурах 488 °С (η), 462 °С (е). ε′-фаза имеет гексагональную решетку с периодами α = 0,992 нм, c=0,432 нм и существует в температурном интервале ∼375...260 °С. к-фаза имеет ромбическую структуру типа Cu 3 Ti, существует в интервале 450...375 °С и распадается на ε-фазу и Cu 2 Sb при температуре 375 °С или ε′-фазу и Cu 2 Sb (по данным других авторов). Фаза η имеет область гомогенности от 15,4 до 15,8% (ат.) Sb при 426 °С. Промежуточная фаза Cu 2 Sb образуется по перитектической реакции при 586 °С и имеет узкую область гомогенности 32,5...33,4% (ат.) Sb. Она имеет тетрагональную решетку . Максимальная растворимость сурьмы в меди в твердом состоянии при температурах 600; 550: 500; 450; 400; 360; 340 и 250 °С составляет 5,79; 5,74; 5,69; 5,44; 4,61; 3,43; 3,02; 1,35% (ат.) или 10,53; 10,44; 10,37; 9,92; 8,48; 6,38; 5,64; 2,56% (по массе) соответственно.
Медь - фосфор
Диаграмма состояния системы медь - фосфор приведена по данным на рис. 11. В системе по результатам более поздних работ обнаружено два соединения: Cu 3 Р и CuР 2 . Температура образования соединения Cu 3 Р непосредственно из расплава дается различными авторами по-разному: 1005; 1018 или 1023; 1022 °С. Область гомогенности соединения Cu 3 Р - 31% (ат.) Р при эвтектической температуре и 27,5% (ат.) Р при 700 °С. Соединение Cu 3 P имеет гексагональную решетку с параметрами α = 0,695 нм, с = 0,712±0,02 нм, c/α=1,02.

Соединение CuР 2 кристаллизуется непосредственно из расплава при 891 °С. Между соединением Cu 3 Р и медью происходит эвтектическая реакция при 714 °С, точка эвтектики отвечает 15,72% (ат.) Р.
Между соединениями Cu 3 Р и CuР 2 существует эвтектическое равновесие при 833 °С. Состав эвтектической точки 49% (ат.) Р.
В области диаграммы между фосфором и соединением CuР 2 предполагается существование вырожденной эвтектики при 590 °С.
Растворимость фосфора в меди приведена в табл. 2 .

(Примечание. В скобках указано содержание фосфора в процентах по массе. )
Медь - хром
Диаграмма состояния медь - хром наиболее подробно исследована в области, богатой медью. Полностью она приведена в работе Г.М. Кузнецова и др. по данным термодинамического расчета и данным о параметрах взаимодействия компонентов (рис. 12). В структуре сплавов присутствуют две фазы: твердые растворы на основе меди (α) и хрома (β). При 1074,8 °С происходит эвтектическое превращение при содержании хрома 1,56% (ат.) . Растворимость хрома в меди по данным разных авторов приведена в табл. 3.


Растворимость меди в хроме в твердом состоянии изменяется от 0,16% (ат.) при 1300 °С до 0,085% (ат.) при 1150 °С.
Медь - цинк
В сплавах меди наибольший практический интерес из элементов II группы периодической системы Д.И. Менделеева представляет цинк. Диаграмма состояния медь - цинк изучена многими исследователями во всем интервале концентраций . На рис. 13 приведена диаграмма состояния, построенная по совокупности работ, в которых использовались методы термического, рентгеновского, металлографического, электронно-микроскопического анализов, определения температуры ликвидуса.
Линия ликвидус системы медь - цинк состоит из шести ветвей первичной кристаллизации фаз α, β, γ, δ, ε и η. В системе пять перитектических превращений, % (ат.):
1) Ж (36,8 Zn) + α (31,9 Zn) ↔ β (36,1 Zn) при 902 °С;
2) Ж (59,1 Zn) + β (56,5 Zn) ↔ γ (59,1 Zn) при 834 °С;
3) Ж (79,55 Zn) + γ (69,2 Zn) ↔ δ (72,4 Zn) при 700 °С;
4) Ж (88 Zn) + δ (76 Zn) ↔ ε (78 Zn) при 597 °С;
5) Ж (98,37 Zn) + ε (87,5 Zn) ↔ η (97,3 Zn) при 423 °С.
Растворимость цинка в твердом растворе на основе меди сначала увеличивается от 31,9% (ат.) при 902 °С до 38,3% (ат.) при 454 °С, затем понижается и составляет 34,5% (ат.) при 150 °С и 29% (ат.) при 0 °С.

В области существования α-фазы определены две модификации α 1 и α 2 . Область существования фазы β находится в пределах от 36,1% (ат.) Zn при 902 °С до 56,5% (ат.) Zn при 834 °С и от 44,8% (ат.) Zn при 454 "С до 48,2% (ат.) Zn при 468 °С. В интервале температур 454...468 °С происходит превращение или упорядочение.
Фаза β′ распадается по эвтектоидной реакции β′↔α + γ при температуре ∼ 255 °С. β-фаза существует в четырех модификациях: γ′′′-фаза до температур 250...280 С, выше 280 °С устойчива γ″-фаза, которая при 550...650 °С переходит в γ′-фазу; выше 700°С существует фаза γ. Фаза δ существует в интервале 700...558 °С, распадаясь эвтектоидно по реакции δ↔γ + ε при 558°С.
Растворимость меди в η-твердом растворе на основе цинка уменьшается от 2,8% (ат.) при 424 °С до 0,31% (ат.) при 100 °С. Периоды решетки α-твердого раствора на основе меди увеличиваются с ростом концентрации цинка.
Фаза β имеет объемно центрированную кубическую решетку типа W, β′-фаза - упорядоченную объемно центрированную решетку типа CsCl. Период решетки β′-фазы увеличивается от О 2956 до 0,2958 нм в интервале концентрации 48,23...49,3% (ат.) Zn.
Фаза γ имеет структуру типа γ-латуни. Ее состав соответствует стехиометрическому составу Cu 5 Zn 8 . γ″′-фаза имеет ромбическую решетку с периодами α = 0,512 нм, b = 0,3658 нм и с = 0,529 нм.
Фаза γ″ имеет кубическую решетку с периодом α = 0,889 нм. Структура и параметры решетки фаз γ′ и γ не определены. Фаза 3 имеет ОЦК решетку с периодом α = 0,300 нм при 600 °С для сплава с 74,5% (ат.) Zn. ε-фаза имеет гексагональную решетку типа Mg.
Сплавы на основе системы медь - цинк (латуни) широко применяются в различных отраслях промышленности: они характеризуются высокой технологичностью, коррозионной стойкостью. Изготовление различных деталей и отливок из сплавов этой системы не представляет особой сложности. Сплавы марок Л96, Л90, Л85, Л80, Л75, Л70, Л68, Л66, Л63, Л59 - простые латуни - обрабатываются давлением в холодном и горячем состоянии и имеют однофазную структуру, представляющую собой твердый раствор на основе меди (а) для сплавов с содержанием меди не менее 61 % (по массе) и двухфазную (α + β) для сплава Л59. Одно- и двухфазные сплавы (α, α + β, β), легированные алюминием, железом, марганцем, кремнием, оловом, свинцом, применяются для получения отливок различными методами.
Цель работы: изучение диаграмм фазового равновесия и фазовых превращений в бинарных сплавах алюминия с другими элементами.
Необходимое оборудование, приспособления, инструмент, материалы: муфельные печи, твердомер ТК-2М, образцы дуралюминов, стенд «Микроструктуры цветных сплавов», металлографический микроскоп.
Краткие теоретические сведения
Алюминий является важнейшим металлом, широко применяемым для изготовления разнообразных алюминиевых сплавов.
Цвет алюминия серебристо-белый со своеобразным тусклым оттенком. Кристаллизуется алюминий в пространственной решетке гранецентрированного куба, аллотропических превращений у него не обнаружено.
Алюминий имеет малую плотность (2,7 г/см 3), высокую электропроводность (составляющую около 60 % электро-проводности чистой меди) и значительную теплопроводность.
В результате окисления алюминия кислородом воздуха на его поверхности образуется защитная оксидная пленка. Наличием этой пленки объясняется высокая коррозионная стойкость алюминия и многих алюминиевых сплавов.
Алюминий достаточно стоек в обычных атмосферных условиях и против действия концентрированной (90-98 %) азотной кислоты, однако он легко разрушается при действии большинства других минеральных кислот (серная, соляная), а также щелочей. Он обладает высокой пластичностью как в холодном, так и горячем состоянии, хорошо сваривается газовой и контактной сваркой, но плохо обрабатывается резанием и отличается низкими литейными свойствами.
Для прокатанного и отожженного алюминия характерны следующие механические свойства: в = 80-100 МПа, = 35-40 %, НВ = 250…300 МПа.
При нагартовке прочность алюминия повышается, а пластичность снижается. Соответственно степени деформации различают отожженный (АД-М), полунагартованный (АД-П) и нагартованный (АД-Н) алюминий. Отжиг алюминия для снятия наклепа проводится при 350…410 С.
Чистый алюминий находит разнообразное применение. Из технического алюминия АД1 и АД, содержащего соответственно не менее 99,3 и 98,8 % Al, изготовляют полуфабрикаты – листы, трубы, профили, проволоку для заклепок.
В электротехнике алюминий служит для замены более дорогой и тяжелой меди при изготовлении проводов, кабелей, конденсаторов, выпрямителей и т. п.
Важнейшими элементами, вводимыми в алюминиевые сплавы, являются медь, кремний, магний и цинк.
Алюминий с медью образует твердые растворы переменной концентрации. При температуре 0 С растворимость меди в алюминии равна 0,3 %, а при температуре эвтектики 548 С она увеличивается до 5,6 %. Алюминий и медь в соотношении 46:54 образуют стойкое химическое соединение CuAl 2 .
Рассмотрим состояние сплавов алюминия с медью в зависимости от их состава и температуры (рис. 1). Линия CDE на диаграмме представляет собой линию ликвидуса, а линия CNDF является линией солидуса. Горизонтальный участок линии солидуса NDF называется также эвтектической линией.
Линия MN показывает переменную по температуре растворимость меди в алюминии. Следовательно, линия MN является границей между ненасыщенными твердыми растворами и растворами насыщенными. Поэтому эту линию часто называют также линией предельной растворимости.
В области I любой сплав будет представлять собой однородный жидкий раствор алюминия с медью, т. е. AlCu.
 Рис.
1. Диаграмма состояния системыAl–CuAl 2
Рис.
1. Диаграмма состояния системыAl–CuAl 2
В областях II и III сплавы будут находиться частично в жидком и частично в твердом состояниях.
В области II
твердой фазой будет твердый раствор
меди в алюминии, а жидкой – жидкий
раствор алюминия и меди, т.е. Al(Cu)
+ (Al Cu),
если твердый раствор ограниченной
растворимости меди в алюминии условимся
обозначать как Al(Cu).
Cu),
если твердый раствор ограниченной
растворимости меди в алюминии условимся
обозначать как Al(Cu).
В области III
жидкой фазой будет являться также жидкий
раствор алюминия и меди, а твердой –
металлическое соединение CuAl 2 ,
т. е.
 +
(Al
+
(Al Cu).
Индекс «I»
(первичный) показывает, что CuAl 2
образовалось при кристаллизации из
жидкого состояния.
Cu).
Индекс «I»
(первичный) показывает, что CuAl 2
образовалось при кристаллизации из
жидкого состояния.
В остальных областях полностью затвердевшие сплавы будут иметь следующее строение:
В области IV – однородный твердый раствор меди в алюминии, т. е. Al(Cu);
В области V
– твердый раствор меди в алюминии и
вторичный
 ;
;
В области VI
– твердый раствор меди в алюминии,
вторичный CuAl 2
и эвтектика, т.е Al(Cu)
+ +Al(Cu)
+ CuAl 2 ;
+Al(Cu)
+ CuAl 2 ;
В области VII
– первичный CuAl 2
и эвтектика, т. е.
 +Al(Cu)
+ CuAl 2 .
+Al(Cu)
+ CuAl 2 .
Эвтектика этих сплавов представляет собой особую механическую смесь чередующихся мельчайших кристаллов твердого раствора меди в алюминии и металлического соединения CuAl 2 , т.е. Al(Cu) + CuAl 2 .
Все сплавы системы Al – CuAl 2 по структуре и концентрации можно разделить на четыре группы:
1-я группа содержит меди от 0 до 0,3 %;
2-я группа содержит меди от 0,3 до 5,6 %;
3-я группа содержит меди от 5,6 до 33,8 %;
4-я группа содержит меди от 33,8 до 54 %.
Рассмотрим строение сплавов системы Al – CuAl 2 . На рис. 2, а показана структура сплава первой группы, состоящая из зерен твердого раствора меди в алюминии. Структура сплава второй группы приведена на рис. 2, б : видны зерна твердого раствора меди в алюминии и кристаллы вторичного CuAl 2 ,
Структура доэвтектического сплава (твердый раствор меди в алюминии, кристаллы вторичного CuAl 2 и эвтектика) приведена на рис. 2, в . Структура эвтектического сплава – эвтектика, состоящая из мельчайших кристалликов твердого раствора меди в алюминии и CuAl 2 дана на рис. 2, г . На рис. 2, д приведена структура заэвтектического сплава, состоящая из первичных кристаллов CuAl 2 и эвтектики.
В сплавах, содержащих эвтектику, можно по структуре определить содержание меди. Однако в этом случае надо учитывать количество меди, находящееся в эвтектике и в твердом растворе. Например, в доэвтектическом сплаве, содержащем 30 % эвтектики и 70 % твердого раствора, количество меди в эвтектике
 ,
,
а в твердом растворе
 .
.

Следовательно, исследуемый сплав содержит
k x + k y = 14,06 % меди,
что соответствует точке А, лежащей на оси абсцисс диаграммы состояния системы Al – CuAl 2 (рис. 1).
При определении
состава заэвтектических сплавов
рассчитывают количество меди, находящееся
в эвтектике и в химическом соединении
 .
Сумма этих количеств будет соответствовать
содержанию меди в заэвтектическом
сплаве. Химическое соединениеCuAl 2
отличается большой твердостью и
хрупкостью.
.
Сумма этих количеств будет соответствовать
содержанию меди в заэвтектическом
сплаве. Химическое соединениеCuAl 2
отличается большой твердостью и
хрупкостью.
В технике применяются преимущественно алюминиевые сплавы, содержащие 2…5 % меди, которые называются дуралюминами. Они хорошо обрабатываются давлением и имеют высокие механические свойства после термической обработки и нагартовки. Дуралюмины применяют для изготовления деталей и элементов конструкций средней и повышенной прочности ( в = 420…520 МПа), требующих долговечности при переменных нагрузках, в строительных конструкциях. Из дуралюмина изготовляют обшивки, шпангоуты, стрингеры и лонжероны самолетов, силовые каркасы и кузова грузовых автомобилей и т.д.
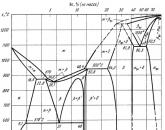
Сплавы Al с Si называют силуминами. Они обладают хорошими литейными свойствами и содержат 4…13 % Si. Из диаграммы состояния этих сплавов (рис. 3) следует, что силумины представляют собой доэвтектические или эвтектические сплавы, содержащие в структуре значительные количества эвтектики.
Однако при литье в обычных условиях эти сплавы приобретают неудовлетворительное строение, так как эвтектика получается грубопластинчатой, с крупными включениями хрупкого кремния, что сообщает сплавам низкие механические свойства.
На рис. 4, а представлена структура силумина марки АЛ2, содержащего 11…13 % Si. В соответствии с диаграммой состояния алюминий – кремний сплав такого состава имеет эвтектическое строение. Эвтектика состоит из -твердого раствора кремния в алюминии (светлый фон) и игольчатых крупных и хрупких кристаллов кремния. Игольчатые выделения частиц кремния создают внутренние острые надрезы в пластичном алюминии и приводят к преждевременному разрушению при нагружении.

Рис. 3. Диаграмма состояния системы Al–Si

Рис. 4. Силумин: а – до модифицирования, грубоигольчатая эвтектика (Al-Si) и первичные выделения кремния;б – после модифицирования, мелкодисперсная эвтектика
(Al-Si) и дендриты твердого раствора кремния и других элементов в алюминии
Введение модификатора меняет характер кристаллизации. Происходит смещение линий диаграммы состояния так, что сплав с 11…13 % кремния становится доэвтектическим. В структуре появляются избыточные светлые зерна -твердого раствора (рис. 4, б ). Модификатор изменяет форму частиц кремния: вместо игольчатых выпадают мелкие равноосные, не создающие опасных концентраций напряжений при нагружении.
В результате модифицирования предел прочности у данных сплавов повышается с 130 до 160 МПа, а относительное удлинение с 2 до 4 %.
В сплавах,
обрабатываемых давлением, содержание
кремния менее 1 %. В алюминиевых сплавах,
содержащих магний, кремний связывается
с ним в устойчивое металлическое
соединение Mg 2 Si;
оно образует с алюминием диаграмму
состояния эвтектического типа с
ограниченными твердыми растворами
( рис.
5).
рис.
5).
Соединение Mg 2 Si отличается высокой твердостью, его переменная растворимость в алюминии позволяет достигать значительного упрочнения при термической обработке.
В электротехнике применяют алюминиевые сплавы типа альдрей, легированные магнием и кремнием. При старении закаленных сплавов Mg 2 Si выпадает из твердого раствора и упрочняет его. В результате такой обработки удается получит предел прочности до 350 МПа при относительном удлинении 10-15 %. Существенно, что электрическая проводимость такого сплава составляет 85 % электрической проводимости проводникового алюминия. Это обусловлено тем, что из твердого раствора при старении почти полностью удаляется Mg 2 Si и сплав состоит из чистого алюминия и упрочняющей фазы (Mg 2 Si).
Р ис.
6. Диаграмма состояния системыAl–Mg
ис.
6. Диаграмма состояния системыAl–Mg
Магний образует с алюминием твердые растворы, а также -фазу на основе соединения Mg 2 Al 3 . В большинство алюминиевых сплавов вводится магния не более 3 %, но в некоторых литейных сплавах типа магналия содержание его доходит до 12 %.
Как видно из рис. 6, в сплавах алюминия с магнием образуется эвтектика. Растворимость магния в алюминии сильно меняется с изменением температуры. В качестве примера можно привести сплав АЛ8. В литом состоянии он имеет структуру, состоящую из зерен твердого раствора магния в алюминии и включений хрупкого соединения Al 3 Mg 2 . После литья проводится гомогенизация при температуре 430 С в течение 15…20 часов, затем следует закалка в масле.
В процессе гомогенизации включения Al 3 Mg 2 полностью переходят в твердый раствор. Закаленный сплав приобретает достаточную прочность ( в = 300 МПа) и большую пластичность. Одновременно сплав приобретает высокую коррозионную стойкость. Старение для сплава АЛ8 является вредным: резко снижается пластичность и ухудшается коррозионная стойкость.
Цинк вводится в некоторые высокопрочные алюминиевые сплавы в количестве до 9 %. В двойных сплавах с алюминием при температуре выше 250 С цинк (в этих пределах) находится в твердом растворе (рис. 7).
 Рис.
7. Диаграмма состояния системыAl–Zn
Рис.
7. Диаграмма состояния системыAl–Zn
Все высокопрочные сплавы имеют сложный химический состав. Так, сплав В95 содержит 6 % Zn, 2,3 % Mg, 1,7 % Cu, 0,4 % Mn и 0,15 % Cr. Цинк, магний и медь образуют с алюминием твердые растворы и металлические соединения MgZn 2 , Al 2 CuMg – S-фаза, Mg 4 Zn 3 Al 3 – T-фаза. При нагревании эти металлические соединения растворяются в алюминии.
Например при температуре 475 ºС растворимость MgZn 2 в алюминии повышается до 18 % (рис. 8).
После закалки и искусственного старения сплав В95 имеет в = 600 МПа, = 12 %. Марганец и хром усиливают эффект старения и повышают коррозионную стойкость сплава.
(мас.)

Рис. 8. Диаграмма состояния системы Al–MgZn 2
Правила техники безопасности
Порядок выполнения работы
Зарисовки микроструктур изученных сплавов с указанием фаз и структурных составляющих.
Копирование диаграммы фазового равновесия, указанной преподавателем.
Для сплава заданного состава описание всех фазовых превращений при нагреве или охлаждении и определение химического состава фаз.
Контрольные вопросы
Почему коррозионная стойкость многих алюминиевых сплавов ниже коррозионной стойкости чистого алюминия?
Можно ли по микроструктуре сплава определить тип сплава – литейный или деформируемый?
Какова структура деформируемых алюминиевых сплавов, не упрочняемых термической обработкой?
Каким путем достигается упрочнение однофазных алюминиевых сплавов?
Какова упрочняющая термическая обработка двухфазных алюминиевых сплавов?
Что является целью закалки дуралюмина?
Каковы основные механические свойства дуралюмина?
Какие сплавы называются силуминами?
Какова удельная прочность алюминиевых сплавов?
Основные легирующие элементы в алюминиевых сплавах.
Области применения
Первичный алюминий
Роль примесей и легирующих элементов
Основные системы легирования и классификация
сплавов
Cтруктура и свойства слитков и отливок
Структура и свойства деформированных
полуфабрикатов
Промышленные алюминиевые сплавы
(доклады студентов)
09.02.2017
2
Учебная литература
И.И. Новиков, В.С. Золоторевский, В.К. Портной идр. Металловедение, том 2. МИСиС, 2014. (Глава 15)
Б.А. Колачев, В.И. Ливанов, В.И. Елагин.
Металловедение и термическая обработка цветных
металлов и сплавов. МИСиС, 2005.
В.С. Золоторевский, Н.А. Белов. Металловедение
цветных металлов. Раздел: Алюминиевые сплавы.
МИСиС, 2000. (№ 1564).
Другая литература (не менее 5 источников)
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
3
Темы докладов c презентацией
1.2.
3.
4.
5.
6.
Силумины
Дуралюмины
Магналии
Жаропрочные алюминиевые сплавы
Высокопрочные алюминиевые сплавы
Литийсодержащие алюминиевые сплавы
В докладах (20-30 минут) рассматриваются химический состав,
структура и свойства промышленных сплавов, области
применения
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
4
Общая характеристика алюминия и его сплавов
Большие запасы (8%Al) в земной коре1-е место среди цветных металлов по объему
производства – более 30 млн т/год (15% РФ)
Цена - 1500-2600 $/т (~1500 $/т)
Легкость – уд.вес 2,7 г/см3
Высокая прочность (сплавов)- в до 700 МПа
Высокая коррозионная стойкость
Высокая электропроводность (2/3 от Cu)
Высокая технологичность при всех видах обработки
Возможность использования отходов
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
5
Области применения алюминия и его сплавов
авиа- и ракетостроениеназемный и водный транспорт
машиностроение
электротехника
строительство
упаковка (для пищи, лекарств и т.д.)
бытовая техника
специальные области
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
6
ПЕРВИЧНЫЙ АЛЮМИНИЙ Химический состав некоторых стандартных марок первичного алюминия (ГОСТ 11069-2001) «Вторичный алюминий» - Al-сплавы из лома
ПЕРВИЧНЫЙ АЛЮМИНИЙХимический состав некоторых стандартных марок первичного
алюминия (ГОСТ 11069-2001)
«Вторичный алюминий» - Al-сплавы из лома и отходов
Марка
Fe, %
Si, %
Cu, %
Zn, %
Ti, %
Ост., %
Всего
примесей, %
Al, %
не
менее
высокой чистоты
А995
0,0015
0,0015
0,001
0,001
0,001
0,001
0,005
99,995
А99
0,003
0,003
0,002
0,003
0,002
0,001
0,01
99.99
А97
0,015
0,015
0,005
0,003
0,002
0,002
0,03
99,97
А95
0,03
0,03
0,015
0,005
0,002
0,005
0,05
99,95
технической чистоты
А85
0,08
0,06
0,01
0,02
0,01
0,02
0,15
99,85
А7
0,16
0,15
0,01
0,04
0,02
0,02
0,30
99,70
А5
0,30
0,25
0,02
0,06
0,03
0,03
0,30
99,50
A35
0,65 (Fe+Si)
0,05
0,1
0,02
0,03
1,00
99,35
A0
0.95 (Fe+Si)
0,05
0,1
0,02
0,03
1,00
99,00
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
7
Физические свойства Al в сравнении с другими металлами
СвойствоAl
Fe
Cu
Температура плавления, 0С
660
1539
1083
650
1652
Температура кипения, 0С 2494
Плотность, г/см3
2872
2,7
2595
7,86
1107
8,9
3000
1,738
4,5
Коэфф. терм. расш., 106* К-1
23,5
12,1
17,0
26,0
8,9
Уд. электросопр., 108* Ом*м
2,67
10,1
1,69
4,2
54
Теплопроводность, Вт*м-1*К-1
238
78,2
397
156
21,6
Теплота плавления, Дж*г-1
405
272
205
293
358
Теплота испарения, кДж*г-1
10,8
6,1
6,3
5,7
9,0
Модуль упругости, ГПа
70
220
132
44
112
Mg
Ti
У чистого Al низкая твердость - 10-15НВ, прочность в=50-70 МПа и высокая
пластичность =30-45%
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
8
Основные примеси в алюминии и его сплавах
ЖелезоКремний
Fe+Si – фазы Al3Fe, Al5FeSi (β) и Al8Fe2Si (α)
Цинк
Медь
Магний
Свинец и олово
Натрий
Водород
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
9
10. ОСНОВНЫЕ БАЗОВЫЕ СИСТЕМЫ ЛЕГИРОВАНИЯ ПРОМЫШЛЕННЫХ АЛЮМИНИЕВЫХ СПЛАВОВ
Al-Si, Al-Si-Mg (силумины)Al-Si-Cu-Mg (медистые силумины)
Al-Cu [-Mn] (жаропрочные)
Al-Mg (магналии)
Al-Mg-Si (авиали)
Al-Cu-Mg (дуралюмины)
Al-Cu-Mg-Si (ковочные)
Al-Zn-Mg (свариваемые)
Al-Zn-Mg-Cu (высокопрочные)
Al-Li-Cu-Mg (сверхлегкие)
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
10
11. Классификация легирующих элементов и примесей в промышленных алюминиевых сплавах по их влиянию на образование различных элементов струк
Классификация легирующих элементов и примесей впромышленных алюминиевых сплавах по их влиянию на
образование различных элементов структуры
Элементы структуры,
образуемые добавками и
примесями
Легирующие
элементы и примеси
Твердый раствор (Al) и основные фазы Cu, Mg, Si, Zn, Li, (Mn) –
-упрочнители при старении
основные легирующие
элементы - сл.12-14
Нерастворимые (при отжиге) эвтекти- Fe, Si, Ni, Mn, (Mg, Cu)
ческие фазы
Первичные кристаллы
Fe, Ni, Mn, Si, (Zr, Cr, Ti)
Дисперсоиды при высокотемператур- Mn, Zr, Cr, Ti, Sc (иногда
ных нагревах
+Сu, Fe, Si и др.)
Микродобавки, мало влияющие на Be, Cd, Sr, Na, Ti, B
09.02.2017
фазовый состав Курс “Структура и свойства цветных металлов и сплавов“
11
12. Диаграмма состояния Al-Cu
13. Диаграмма состояния Al-Mg
14. Диаграмма состояния Al-Si
15. Характеристики диаграмм состояния эвтектического типа, образуемых алюминием с основными легирующими элементами
№Легирую- Сп,
щие
мас.%
элементы (ат.%)
Се,
мас.%
(ат.%)
Tпл,
0C
Фаза в равновесии с (Аl)
(содержание
второго
компонента, мас.%)
1
Cu
5,7 (2,5)
33,2
(17,5)
548
CuAl2 (52%Cu)
2
Mg
17,4 (18,5) 35
(36) 450
Mg5Al8 (35%Mg)
3
Zn
82
(49,3)
94,9
(75) 382
(Zn)
(>99%Zn)
4
Si
1,65
(1,59)
12
(12)
(Si)
(>99,5%Si)
09.02.2017
577
Курс “Структура и свойства цветных металлов и сплавов“
15
16. Характеристики двойных фазовых диаграмм алюминия с переходными металлами, присутствующими в алюминиевых сплавах в качестве примесей или
Характеристики двойных фазовых диаграмм алюминия спереходными металлами, присутствующими в алюминиевых
сплавах в качестве примесей или легирующих элементов (см. слайд
11)
№
Легирующие
элементы
(тип диаграммы)
Сп,
масс.%
(ат.%)
1
Fe (e)
0,05
(0,03) 1,8
(0,9) 655
FeAl3 (40%Fe)
2
Ni (e)
0,04
(0,02) 6,0
(2,8) 640
NiAl3 (42%Ni)
3
Ce (e)
0,05
(0,01) 12
(2,6) 650
CeAl4 (57%Ce)
3
Mn (e)
1,8
(0,89) 1,9
(0,91) 658
4
Sc (e)
0,3
(0,2)
0,6
(0,4) 655
ScAl3 (36%Sc)
5
Ti (p)
1,3
(0,8)
0,12
(0,08) 661
TiAl3 (37%Ti)
6
Zr (p)
0,28
(0,1)
0,11
(0,04)
661
ZrAl3 (53%Zr)
7
Cr (p)
0,8
(0,4)
0,4
(0,2) 661
CrAl7 (22%Cr)
09.02.2017
Се,p ,
мас.%
(ат.%)
Te,p, 0C
Фаза в равновесии с
(Аl)
(содержание
второго компонента,
масс.%)
MnAl6 (25%Mn)
Курс “Структура и свойства цветных металлов и сплавов“
16
17. Области составов алюминиевых сплавов и их классификация по структуре
1.Сплавы типа твердых растворов(матричные) (подавляющее
большинство деформируемых
сплавов, а также литейные на
базе систем Al–Cu, Al–Mg и AlZn-Mg);
2.Доэвтектические сплавы
(большинство силуминов сплавов, в которых важнейшим
легирующим элементом является
кремний, например типа АК7 и
АК8М3, а также некоторые
деформируемые сплавы, в
частности типа АК4-1);
3.Эвтектические сплавы (силумины
типа АК12 и АК12М2);
4.Заэвтектические сплавы
(заэвтектические силумины,
например АК18).
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
17
18.
Общие особенностиструктуры и свойств слитков
и отливок из алюминиевых
сплавов
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
18
19. Неравновесная кристаллизация
Микроструктурасплава Al-5% Cu
Н
е
09.02.2017
Неравновесная кристаллизация – результат
неполного прохождения диффузии при
реальных скоростях охлаждения
Курс “Структура и свойства цветных металлов и сплавов“
19
20. Метастабильные варианты фазовых диаграмм Al-ПМ
09.02.2017Курс “Структура и свойства цветных металлов и сплавов“
20
21. Типичная макро- и микроструктура доэвтектических литых алюминиевых сплавов
09.02.2017Курс “Структура и свойства цветных металлов и сплавов“
21
22. Микроструктуры литых сплавов
23. ХАРАКТЕРИСТИКИ ЛИТОЙ СТРУКТУРЫ
1) форма и размер кристаллитов (зерен) ;2) форма и размер дендритных ячеек (Al);
3) состав, структура, морфология и объемная доля частиц
избыточных фаз кристаллизационного происхождения
4) распределение легирующих элементов и примесей в
(Al)
5) характеристики субструктуры (распределение и
плотность
дислокаций,
размеры
субзерен
и
дислокационных ячеек, углы их разориентировки,
вторичные выделения);
6) количество, размер и распределение пор
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
23
24. Соотношение между размером дендритной ячейки (d) и скоростью охлаждения (Vохл) d=A V-nохл
Vохл, K/c10-3
d, мкм
1000
Условия получения отливок
100
100
Непрерывное
литье
103
10
Литье крупных гранул (в воду)
106
1
Получение чешуек (спиннингование)
109
0,1
Получение ультратонких чешуек
09.02.2017
Литье крупных отливок в землю
литье
слитков,
Курс “Структура и свойства цветных металлов и сплавов“
кокильное
24
25. Концентрационная граница появления неравновесной эвтектики (Ск на cлайде 20)
Концентрационная граница появлениянеравновесной эвтектики (С на cлайде 20)
к
С, %
Cu
Mg
Zn
Si
Равновесная
предельная
растворимость
Сп, %
5,65
17,4
82,2
1,65
0,5-2 K/мин
0,1
4,5
20,0
0,1
80-100 K/мин
0,1
0,5
2,0
0,1
1000 K/мин
0,3
1,0
3,0
0,2
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
25
26. Объемная доля (QV) и размер (m) частиц избыточных фаз и пор
QV = Cx/Ce)1/(1-К),где
Сe – эвтектическая концентрация,
К - коэффициент распределения (Сж/Cтв),
Сx - концентрация легирующего элемента в сплаве.
m = Bd,
где d – размер дендритной ячейки
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
26
27. МОРФОЛОГИЯ ИЗБЫТОЧНЫХ ФАЗ
Большое количество и разнообразие формы частиц избыточных фаз, втом числе одной и той же фазы при кристаллизации в разных
условиях:
1) прожилки по границам дендритных ячеек;
2) скелеты;
3) иглы, пластины;
4) тонкодифференцированные кристаллы (внутри
эвтектики) в сплавах, близких к эвтектической точке и др.
С увеличением скорости охлаждения и кристаллизации размеры частиц
уменьшаются
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
27
28. Разная морфология избыточных фаз
09.02.2017Курс “Структура и свойства цветных металлов и сплавов“
28
29. Модифицирование литой структуры
Модифирование для измельченияпервичных кристаллов
Примеры модификаторов: зерна (Al) - Ti и
Ti+B, первичного (Si) – Cu+P
Модифицирование эвтектик
Модификаторы (Si) в эвтектике: хлориды, Sr,
РЗМ – изменяют форму монокристаллов,
кристаллизующихся внутри эвтектических
колоний
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
29
30. Основные Fe- и Si-содержащие фазы в алюминиевых сплавах
Al3Fe, α(Al8Fe2Si), β(Al5FeSi)Al15(Fe,Mn)3Si2
Al6(Fe,Cu,Mn), Al7FeCu2
Al9FeNi
Al8FeMg3Si6
Распределение легирующих элементов по сечению
дендритных ячеек (Al) - слайд 23
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
30
31. Внутренняя структура дендритов (Al)
32.
Изменение структуры исвойств слитков и отливок
при гомогенизационном
отжиге
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
32
33. Структурные изменения при гомогенизации и закалке
растворение неравновесного избытка фазкристаллизационного происхождения;
2) устранение внутрикристаллитной ликвации
легирующих элементов;
3) распад алюминиевого раствора во время
изотермической выдержки с образованием
алюминидов переходных металлов (в сплавах,
содержащих такие добавки);
4)
изменение
морфологии
фаз
кристаллизационного
происхождения,
не
растворимых в твердом растворе
1)
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
33
34. Растворение неравновесных фаз в результате диффузии
гдеP= (Q ·A·d/2) / (D·S·(B+K·Q) ,
P - время полного растворения -фазы
d - размер дендритной ячейки;
Q - объемная доля неравновесной -фазы;
S - суммарная поверхность ее включений;
D - коэффициент диффузии легирующего элемента в
(Al);
A, В и К - коэффициенты, постоянные для сплава
заданного состава
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
34
35. Растворение неравновесных фаз
Эмпирические уравнения:p=b0 + b1m или p = amв,
где m – толщина растворяющихся частиц
- отливки сплава АМг9 при температуре
гомогенизации 4400С p = -1,6 + 0,48m,
- слитки сплава Д16 при температуре гомогенизации
4800C р = 0,79 + 1,66m или
p = 0,63 m1,2 (m - в мкм, p - в час).
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
35
36. Устранение внутрикристаллитной ликвации
= 5,8l02/(2D),где l0 = d/2
D- коэф. диффузии при Тгом, см2/c:
Mg, Zn, Si - 10-9
Cu - 10-10
Ni - 10-12
Fe, Mn, Cr, Zr -10-13 - 10-14
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
36
37. Дисперсоиды алюминидов Mn, Zr и Ti
38. Фрагментация и сфероидизация эвтектического кремния при нагреве под закалку
39.
Структурные изменения пригомогенизации и закалке
(продолжение слайда 33)
5) изменение зеренной и дислокационной
структуры алюминиевого твердого раствора;
6) распад алюминиевого раствора по основным
легирующим элементам при охлаждении после
изотермической выдержки;
7) развитие вторичной пористости.
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
39
40. Тонкая структура после закалки и старения отливок (ПЭМ)
41.
Общие особенностиструктуры и свойств
деформированных
полуфабрикатов
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
41
42. . СТРУКТУРА И СВОЙСТВА ДЕФОРМИРОВАННЫХ ПОЛУФАБРИКАТОВ ИЗ АЛЮМИНИЕВЫХ СПЛАВОВ
Деформация:«холодная» - при комнатной температуре
теплая - между комнатной и
0,5-0,6 Тпл
горячая- выше 0,5-0,6 Тпл
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
42
43. Напряжение течения
Напряжение течения-
холодной и теплой деформации алюминия напряжение течения непрерывно
растет с момента начала деформации и вплоть до разрушения по степенному
закону:
- При
где и m - коэффициенты, m < 1
- При горячей ОМД
= m,
σ примерно постоянно (установившаяся стадия)
после 10-50%-ной деформации
- Совместное влияние температуры Т и скорости деформации на σ
определяется (через структуру) параметром Зинера-Холомона:
Z = exp(Q/kTдеф).
σ линейно зависит от lgZ
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
43
44.
СТРУКТУРА ДЕФОРМИРОВАННЫХПОЛУФАБРИКАТОВ ДО И ПОСЛЕ
ТЕРМИЧЕСКОЙ ОБРАБОТКИ
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
44
45. Волокнистая (а) и рекристаллизованная (б) зеренная структура (СМ)
а09.02.2017
б
Курс “Структура и свойства цветных металлов и сплавов“
45
46. Карта структуры после многократной прокатки методом анализа картины обратно рассеянных электронов EBSD в СЭМ
09.02.2017Курс “Структура и свойства цветных металлов и сплавов“
46
47. ТЕКСТУРЫ ДЕФОРМАЦИИ
1. В катаных листах - двойная текстура прокатки {110}<112> (основная втехническом Al) и {112}<111> (основная в сплавах).
2. После прессования, волочения, прокатки прутков и проволоки
круглого сечения образуется двойная аксиальная текстура <111> и
<100>.
3. В прессованных полосах и тонкостенных профилях – текстура
прокатки + аксиальная при больших отношениях толщины к
ширине.
4. В трубах, получаемых прессованием, прокаткой и волочением, «цилиндрическая» текстура (текстура прокатки после разрезки
трубы и разворота ее в плоскость).
5. В осаженных прутках – аксиальная текстура <110>
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
47
48. Диаграмма структурных состояний закаленного деформируемого сплава АК8 в зависимости от температуры и скорости горячей деформации при оса
Диаграмма структурных состояний закаленногодеформируемого сплава АК8 в зависимости от
температуры и скорости горячей деформации при
осадке
прессование
штамповка
прокатка
ковка
09.02.2017
1 - рекристаллизации
нет;
2- полная
рекристаллизация;
3- рекристаллизация
начинается после
деформации;
4- смешанная структура
Курс “Структура и свойства цветных металлов и сплавов“
48
49. Субструктура (Al) после возврата и строчечность частиц в волокнистом полуфабрикате
0,5 мкм09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
49
50. Дисперсоиды в конечной структуре деформированных полуфабрикатов (ПЭМ)
1 мкм1мкм
200 нм
200 нм
51. Термомеханическая обработка алюминиевых сплавов
ВТМО – горячая деформация с получениемполигонизованной структуры, сохраняющейся после
закалки или отжига – упрочнение по сравнению с
рекристаллизованным состоянием (Al) («прессэффект» или «структурное упрочнение»)
НТМО – холодная деформация (прокатка) после
закалки перед старением
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
51
52. Cпособы получения нанокристаллической структуры -введением при распаде (Al) наночастиц фаз-упрочнителей (в литейных и деформируемых сплава
Cпособы получениянанокристаллической структуры
-введением при распаде (Al) наночастиц фазупрочнителей
(в литейных и деформируемых сплавах)
-путем интенсивной пластической
деформации разными способами:
кручение под гидростическим
давлением (КГД)],
равноканальное угловое прессование
(РКУП),
многократная прокатка,
механическое легирование
и другие для получения наноразмерного зерна
в (Al)
53.
09.02.2017Курс “Структура и свойства цветных металлов и сплавов“
53
54. Интенсивная пластическая деформация (ИПД)
1ln(1)
Интенсивная пластическая
деформация (ИПД)
Величина деформации в работах по ИПД
рассчитывается по формуле ε=-ln(1- /1), где для
листов – это разность исходного размера (диаметра
или толщины) заготовки и размера после деформации.
Например, если исходная заготовка имела толщину 10
мм, а в результате прокатки мы получили из нее лист
толщиной 1 мм, то
ε=-ln{1- (10-1)/10}=ln(0,1)=2,3.
При ИПД ε может достигать 3-4 и более за один проход
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
54
55. Схемы РКУП и КГД
РКУП - многократное продавливание образца черезканал без изменения его
формы
.
КГД-деформация за счет сил трения по
поверхности дискового образца
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
55
56. Промышленные литейные алюминиевые сплавы
Базовые системы легирования,маркировка.
Химический и фазовый состав.
Особенности структуры и свойств
силуминов и литейных сплавов на
основе систем Al – Mg, Al – Cu и Al – Zn
– Mg
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
56
57. Системы обозначения промышленных литейных алюминиевых сплавов в России и США
Базовая системаAl-Cu
Al-Si-Cu, Al-Si-Mg,
Al-Si-Cu-Mg
Al-Si
Al-Mg
Al-Zn
Al-Sn
09.02.2017
США (АА)
2XX.0 (224.0)
3XX.0 (356.0)
4XX.0 (413.0)
5XX.0 (514.0)
7XX.0 (710.0)
8XX.0 (850.0)
Россия (ГОСТ 1583-89)
(АМ5)
(АК12М2МгН)
(АК12)
(АМг5К)
Курс “Структура и свойства цветных металлов и сплавов“
57
58. Сравнительная характеристика свойств литейных сплавов
СистемаПрочн.
Кор.
стойк.
Лит.
св-ва
Свар.
Al-Si
1
2
1
2
3
3
Al-Si-Mg
2
1-2
1
2
3
3
Al-Si-Cu
2
1-2
2
1
3
3
Al-Si-Cu-Mg
2-3
1
2
1
2-3
3
Al-Cu
3
3
3
1
1
2
Al-Mg
1-2
3
1
3
2
3
09.02.2017
Пласт. Жаропроч.
Курс “Структура и свойства цветных металлов и сплавов“
58
59. Гарантируемые механические свойства силуминов по ГОСТ 1583-93
Маркисплавов
Способ
литья
Состояние
АК7ч
К
Т6
235
1
70
АК9ч
З, К
Т6
230
3
70
АК8М3ч
К
Т5
390
4
110
АК12ММг
Н
К
Т6
215
0,7
100
09.02.2017
в,МПа, %
Курс “Структура и свойства цветных металлов и сплавов“
НВ
59
60. Механические свойства литейных сплавов на базе систем Al–Cu и Al–Mg по ГОСТ 1583-93
СплавАМ5
АМ4,5Кд
АМг6л
АМг6лч
АМг10(АЛ27)
09.02.2017
Способ
литья
в, МПа
, %
НВ
З
333
4
90
К
333
4
90
К
490
4
120
З
190
4
60
К
220
6
60
З, К
230
6
60
З
200
5
60
К
240
10
60
З, К
250
10
60
З, К
320
12
75
Курс “Структура и свойства цветных металлов и сплавов“
60
61. Промышленные деформируемые сплавы
Базовые системы легирования, маркировка,химический и фазовый состав
Термически неупрочняемые сплавы на основе
систем Al – Fe – Si, Al – Mg, Al – Mn,
особенности их структуры и свойств.
Термически упрочняемые сплавы на основе
систем Al – Cu, Al – Mg, Al – Mg – Si,
Al – Cu – Mg, Al – Zn – Mg – Cu, Al – Mg – Cu –
Li.
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
61
62. Системы обозначений промышленных деформируемых алюминиевых сплавов в России и США
Базоваясистема
>99.0% Al
Al-Cu
Al-Mn
Al-Si
Al-Mg
Al-Mg-Si
Al-Zn
Остальные
09.02.2017
США (АА)
1ХХX
2XXX
3XXX
4XXX
5XXX
6XXX
7XXX
8XXX
(1180)
(2024)
(3005)
(5086)
(6010)
(7075)
(8111)
Россия (ГОСТ 4784-74)
Цифровая – (буквенная)
10YY –
(АД1)
11YY – (Д16, АК4-1)
14YY – (АМц)
15YY – (АМг6)
13YY – (АВ, АД31)
19YY –
(В95)
–
- (АЖ0.8)
Курс “Структура и свойства цветных металлов и сплавов“
62
63. Концентрация основных легирующих элементов в промышленных деформируемых сплавах
Cu, %Mg, %
Zn, %
Si, %
Li, .%
Al-Cu-Mg
3-5
0,5-2
-
-
-
Al-Mg-Si
-
0,3-1,2
-
0,3-1,2
-
Al-Zn-Mg
-
1-3
3-6
-
-
Al-Cu-Mg-Si
1-5
0,3-1,2
-
0,3-1,2
-
Al-Zn-Mg-Cu
0,5-3
1-3
5-9
-
-
Al-Li-Cu-Mg
0–4
0-5
–
–
1–3
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
63
64. Сравнительная характеристика свойств деформируемых сплавов
Базоваясистема
Прочн. Пласт. Жароп.
Корр.
Дефор.
Свар.
Al-Mg
1-2
3
1
3
2
3
Al-Cu
3
3
3
1
2
2
Al-Mg-Si
2
3
2
3
3
2
Al-Cu-Mg
3
3
2
1
3
1
Al-Zn-Mg
1
2
1
3
3
2
Al-Zn-Mg-Cu
3
2
1
2
2
1
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
64
65. Обозначение некоторых состояний для деформируемых алюминиевых сплавов
Вид термообработкиОбозначение в
РФ1)
Обозначение
в США2)
Без термообработки, без контроля наклепа
–
F
Отжиг для полного снятия наклепа
М
O
Нагартованное состояние без термообработки
Н
H1
Нагартованное и частично отожженное состояние
Н1, Н2, Н3
H2
Нагартованное и стабилизированное состояние
–
Н3
Закалка после деформации плюс естественное
старение
T
T4
Закалка после деформации плюс старение на
максимальную прочность
T1
T6
Закалка после деформации плюс перестаривание
Т2, Т3
T7
Закалка после деформации, холодная деформация,
искусственное старение (НТМО)
T1Н
T8
1)
русские буквы,
09.02.2017
2)
латинские буквы
Курс “Структура и свойства цветных металлов и сплавов“
65
66. Типичные механические свойства термически неупрочняемых алюминиевых деформируемых сплавов
СплавВид полуфабриката
Состояние
в,
МПа
0,2,
МПа
, %
АД00
Лист
М
60
–
28
АД1
Лист
Н
145
–
4
АМц
Лист
Н
185
–
4
АМг2
Лист
М
165
–
18
АМг2
Профиль
М
225
60
13
АМг3
Лист
М
195
100
15
АМг6
Лист
М
155
155
15
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
66
67. Типичные механические свойства термически упрочняемых алюминиевых деформируемых сплавов
СплавВид полуфабриката
Состояние
в, МПа
0,2, МПа
, %
Д16
Лист
Т
440
290
11
Д20
Поковка
Т1
375
255
10
АК8
Пруток
Т1
450
–
10
АВ
Лист
М
145
–
20
АВ
Профиль
Т1
294
225
10
АД31
Пруток
Т1
195
145
8
В95
Пруток
Т1
510
420
6
В96ц
Поковка
Т1
590
540
4
1915
Лист
Т
315
195
10
АК4-1
Пруток
Т1
390
315
6
1420
Профиль
Т1
412
275
7
1450
Лист
Т1
490
430
4
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
67
68. Пример билета к контрольной работе
1.2.
3.
4.
5.
В какой области диаграммы состояния
находятся составы алюминиевых сплавов с
хорошими литейными свойствами?
Какие процессы идут при закалке
деформированных полуфабрикатов из
алюминиевых сплавов?
Модифицирование структуры литейных
алюминиевых сплавов
Структура и свойства дуралюминов
Безмедистые силумины
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
68
69. Тугоплавкие металлы и сплавы
70. План раздела
Тугоплавкие металлы, их распространенность в земной коре,применение. Металлы «большой четверки».
Общие особенности электронной и кристаллической структуры
тугоплавких металлов с ОЦК решеткой.
Физические свойства.
Химические свойства. Способы защиты тугоплавких металлов от
взаимодействия с газами воздуха
Состав защитных покрытий и способы их нанесения на тугоплавкие
металлы и сплавы.
Механические свойства: проблемы хладноломкости и жаропрочности
Принципы легирования тугоплавких металлов с целью создания
жаропрочных сплавов.
Промышленные сплавы.
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
70
71. Максимальные рабочие температуры жаропрочных сплавов на разной основе
09.02.2017Курс “Структура и свойства цветных металлов и сплавов“
71
72. Особенности электронной структуры
Тугоплавкие металлы IV-VII групп – переходныеd-элементы
V и Cr расположены в I-ом большом периоде, Zr,
Nb и Mo во II-ом, Ta, W, Nb и Re – в III-ем
Соответственно у них не полностью заполнены
3d-, 4d- и 5d-уровни, а количество электронов на
внешних уровнях почти одинаково
В результате кристаллическая структура у всех
этих металлов тоже близка
Как минимум одна модификация имеет ОЦК
решетку со всеми ее особенностями
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
72
73. Распространенность в земной коре, кристаллическая структура и некоторые физические свойства тугоплавких металлов
Плотность,г/см3
Удельное
электросопротивление,
мкОм·см
Температура
перехода
в сверх проводящее
состояние,
К
Поперечное
сечение
захвата
тепловых
нейтронов,
барны
Металл
Содержание
в
земной
коре,
%
Тип
кристаллической
решетки
Цирконий
0,022
-ГП
-ОЦК
1852
6,5
42
0,7
0,18
Ванадий
0,0150
ОЦК
1900
6,14
24,8
5,13
4,98
Ниобий
0,0024
ОЦК
2468
8,58
12,7
9,22
1,15
Тантал
0,00021
ОЦК
3000
16,65
12,4
4,38
21
Хром
0,020
ОЦК
1875
7,19
12,8
-
3,1
Молибден
0,0015
ОЦК
2625
10,2
5,78
0,9-0,98
2,7
Вольфрам
0,0069
ОЦК
~3400
19,35
5,5
0,05
19,2
Рений
1·10-7
ГП
3180
21,02
19,14
1,7
86
Медь
0,007
09.02.2017
Температура плавления, 0С
Курс “Структура и свойства цветных металлов и сплавов“
73
74. Температура плавления переходных металлов трех длинных периодов
Максимум Тпл – при6 (d+s)-электронах
когда максимальна
прочность сил межатомной связи
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
74
75. Химические свойства Схемы зависимости скорости окисления от времени при постоянной температуре
Покисление начинаетСильное
р 400-5000С.
при т-рах
Причины
и линейного окислен
-низкая Тпл и Ткип оксида
(279 и 3630С у Re2O7, 795 и
14600С у МоО3),
-рыхлая крист. решетка, силь
отличающаяся от маталла
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
75
76. Взаимодействие с водородом и азотом
С водородом металлы VI-группы и рений втвердом состоянии не взаимодействуют
Металлы IV- и V-групп активно
взаимодействуют с водородом выше 250-3000С
с образованием гидридов
С азотом взаимодействуют все тугоплавкие
металлы, особенно IV группы, меньше других хром
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
76
77. Защитные атмосферы и покрытия
Защитные атмосферы: вакуум, аргон,водород (для W и Mo)
Защитные покрытия получают
хромированием, силицированием,
оксидированием (Al2O3, ThO2, ZrO2),
многослойным вакуумным напылением (Cr,
Si) с последующим диффузионным
отжигом
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
77
78. Механические свойства 2 основные проблемы –хладноломкость и жаропрочность Температурные зависимости относительного сужения
09.02.2017Курс “Структура и свойства цветных металлов и сплавов“
78
79. Природа хладноломкости ОЦК металлов
1.Роль примесей, особенно образующих растворывнедрения
-предельная растворимость
-сегрегация на дислокациях
-равновесная сегрегация на границах
зерен
-образование частиц избыточных фаз
2. Влияние дислокационной структуры
3. Влияние зеренной структуры
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
79
80. Растворимость углерода, азота и кислорода в тугоплавких металлах VА и V1А-подгрупп при комнатной температуре
МеталлРастворимость ▪ 10-4 , %
углерода
азота
кислорода
Молибден
0,1 -1
1
1
Вольфрам
< 0,1
<0,1
<1
Ниобий
100
200
1000
Тантал
70
1000
200
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
80
81. Схемы структур тугоплавких ОЦК металлов в различных состояниях а – г -структуры в световом микроскопе; д – ж -дислокационная структура фол
Схемы структур тугоплавких ОЦК металлов в различныхсостояниях
а – г -структуры в световом микроскопе;
д – ж -дислокационная структура фольги в электронном микроскопе;
а – литое состояние; б – деформированное;
в – рекристаллизованное состояние; г – монокристалл;
д – гомогенное распределение дислокаций;
е – ячеистая структура; ж – полигонизованная структура
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
81
82. Схемы изменения температуры хрупко -вязкого перехода тугоплавких металлов (Тхр) при легировании
09.02.2017Курс “Структура и свойства цветных металлов и сплавов“
82
83. Способы уменьшения хладноломкости
Снижение концентрации примесейвнедрения
Устранение сетки высокоугловых границ
Создание полигонизованной структуры
Измельчение зерна
Легирование рением и химически
активными элементами
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
83
84. Температурные зависимости предела прочности (а) и удельной прочности (б) тугоплавких металлов
а09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
б
84
85. Влияние легирования на жаропрочность
Твердорастворное упрочнение добавками,повышающими или слабо снижающими
солидус металла – основы, т.е. другими
тугоплавкими элементами
Фазы – упрочнители: чаще всего карбиды, а
также нитриды, оксиды, бориды
Способы введения частиц фаз-упрочнителей –
порошковая металлургия,
- «слиточная» технология
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
85
86. Диаграмма состояния Ti – Mo
09.02.2017Курс “Структура и свойства цветных металлов и сплавов“
86
87. Диаграмма состояния Mo – W
09.02.2017Курс “Структура и свойства цветных металлов и сплавов“
87
88. Диаграмма состояния Zr – Nb
09.02.2017Курс “Структура и свойства цветных металлов и сплавов“
88
89. Схема конструирования состава жаропрочных сплавов на основе металлов «большой четверки»
Ме-основа (Мо, W, Nb, Ta) + растворимыедобавки для повышения жаропрочности (те
же металлы) и низкотемпературной
пластичности (Ti, Zr, Hf, РЗМ)+ добавки,
образующие фазы –упрочнители (С и
другие металлоиды)
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
89
90. Температурные зависимости предела прочности вольфрамовых сплавов
09.02.2017Курс “Структура и свойства цветных металлов и сплавов“
90
91.
Расшифровка кривых на слайде 94Номер
кривой
Сплав
Метод получения
Состояние или обработка
1
100% W
Порошковая металлургия
Деформированный лист
2
W 100%W
-”-
Кованный пруток
3
W +10%Mo
-”-
-”-
4
W +15%Mo
Дуговая плавка
-”-
5
W +20%Mo
Электроннолучевая плавка
12050С, 1 час
6
W +25%Mo
Порошковая металлургия
Кованный пруток
7
W +30%Mo
Электроннолучевая плавка
12050С, 1 час
8
W +50%Mo
Порошковая металлургия
Кованный пруток
9
W +1%Th02
-”-
-”-
10
W +2%Th02
-”-
-”-
11
W +0,12%Zr
Дуговая плавка
Прессование, ковка
12
W +0,57%Nb
-”-
-”-
13
W +0,88%Nb
-”-
-”-
14
W +0,38%TaC
Порошковая металлургия
Ковка + 10000С, ½ ч
15
W +1.18%Нf + 0,086%С
-”-
Прессование, ковка
16
W +0.48%Zr + 0,048%С
-”-
-”-
17
Cплав ВВ2
Дуговая плавка
-”-
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
91
92. Химический состав и свойства молибденовых сплавов в отожженном состоянии
Среднее содержание, %Температура
начала
рекристаллизации, 0С
σв при
1315 0С,
МПа
σ100
при
1315 0С,
МПа
Марка
сплава
Ti
Zr
W
Nb
C
Mo
-
-
-
-
<0.005
1100
150
30
ЦМ-5
-
0,45
-
-
0,05
1600
360
140
ЦМ-2А
0,2
0,1
-
-
≤0,004
1300
160 при
1400 0С
65
до 0,6
-
≤0,01
1300
190 при
1400 0С
90 при
1200 0С
-
1,4
0,3
1650
380
265
ВМ-1
ВМ-3
09.02.2017
до 0,4 0,15
1
0,45
Курс “Структура и свойства цветных металлов и сплавов“
92
93. Химический состав и свойства ниобиевых сплавов
Плотность,г/см3
Температура
начала
рекристаллизации, 0С
Предел
прочности в
отожженном
состоянии
при 12000С
σв, МПа
Группа
сплавов
Марка
сплава
Среднее
содержание
легирующих
элементов, %
Малопрочные
ВН-2
4,5 Mo
8,6
1000
190
ВН-2А
4 Mo; 0.7Zr;<0,08C
8,65
1200
240
ВН-3
4,6Mo; 1.4Zr; 0.12C
8,6
1200
250
ВН-4
9,5Mo; 1,5Zr;
0,3C; 0,03Ce; La
-
1400
2500
Среднепрочные
Высокопрочные
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
93
94. Радиоактивные металлы
95. План раздела
Радиоактивный распад и цепная ядерная реакция.Ядерный реактор.
Уран.
Физические, химические и механические свойства урана.
Радиационное повреждение урана. Радиационный рост
урана.
Газовое распухание урана и способы борьбы с ним.
Размерная нестабильность урана при работе реакторов.
Основные легирующие элементы.
Сплавы урана
Плутоний и его сплавы
Торий и его сплавы
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
95
96. Состав ядер атомов
-23радиоактивных металла, используются в основном U, Pu и Th.
-Ядро состоит из нуклонов – положительно заряженных протонов и
нейтронов, имеющих примерно одинаковую массу.
-Число протонов Z (положительный заряд ядра) равно числу электронов.
-Заряд ядра Z равен суммарному числу протонов (или электронов)
-Число нуклонов (массовое число) М = Z + N (N – число нейтронов).
-У многих элементов при одном Z несколько значений N и М
-Изотопы – атомы с одинаковым Z, но разным М.
-Нуклоны в ядре связаны ядерными силами, на 6 порядков большими,
чем электростатические силы отталкивания протонов.
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
96
97. Распад и синтез ядер При увеличении Z ядерные силы сначала растут, а потом у тяжелых элементов уменьшаются. Синтез легких и распад тяжелых я
Распад и синтез ядерПри увеличении Z ядерные силы сначала растут, а потом у тяжелых
элементов уменьшаются.
Синтез легких и распад тяжелых ядер сопровождается выделением большой
энергии.
Условие стабильности ядра:
M
Z
2
1,98067 0, 0149624 M 3
Дефект массы при потере или приобретении энергии: m = E/c2,
где E – величина выделяющейся или приобретаемой энергии;
c – скорость света.
При образовании в результате синтеза ядер 1 кг гелия m = 80 г. При этом
выделяющаяся энергия E = 4,47 ·1028 МэВ (как при сгорании 20 000 т угля).
При распаде ядер тяжелых элементов также образуется огромная энергия (при
распаде ядер 1 кг U в 8 раз меньшая, чем при синтезе 1 кг He)
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
97
98. Разновидности реакций распада ядер радиоактивных изотопов (естественная радиоактивность)
1.2.
3.
- распад с выделением –частицы (ядра гелия с
М=4 и Z=2). При этом образуется новое ядро.
Например, 226Ra88 4 2 + 222Rn86.
Позитронный или +-распад (позитрон – 0e+1)
Например, 30P15 0e+1 + 30Si14 + 0 0 ,
где
-нейтрино.
К – захват. Ядро захватывает электрон с оболочки
своего атома (чаще всего с К –оболочки), который
соединяется с протоном, образуя нейтрон.
Например, 55Fe26 + 0e-1 54Mn25 + 1n0.
При избытке нейтронов в ядре они распадаются: 1n0
1P1 + 0e-1 +0 0.
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
98
99. Реакции при бомбардировке ядер частицами
Ядерные реакции – поглощение частиц –бомбардиров ядрамиЕсли частица не поглощается ядром, то говорят о рассеянии
Если частица поглощается ядром, то образуется короткоживущее
(<10-16 сек) ядро, превращающееся в другое, испуская одну или
несколько частиц
Возможно образование «возбужденных» ядер, которые отдают
свой избыток энергии в виде электромагнитного излучения
Во всех ядерных реакциях Z и M остаются неизменными, а в
результате реакции выделяется или поглощается энергия
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
99
100. Эффективное поперечное сечение бомбардируемых ядер (характеризует вероятность прохождения ядерной реакции)
Эффективное поперечное сечениебомбардируемых ядер (характеризует
вероятность прохождения ядерной
реакции)
P = F N d ,
где P – число ядерных процессов;
F – число частиц-снарядов;
d – толщина фольги–мишени;
N – число ядер.
-Размерность – барны (1 барн = 10-24 см2).
-Наилучшие частицы-бомбардиры – нейтроны, которые
легко можно получать в реакторах и для которых не
существует кулоновского барьера.
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
100
101. Схема зависимости энергии связи ядра на 1 нуклид (Q/М) от массового числа М
Реакциейделения
можно
управлят
С ядер
Синтез
и
(идет
в термоядерных
реакциях) пока
неуправляем
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
101
102. Схема зависимости % выхода образующихся при делении ядер урана и тория от массового числа М
09.02.2017Курс “Структура и свойства цветных металлов и сплавов“
102
103. Цепная ядерная реакция
При делении ядер в результате их бомбардировкинейтронами выделяется энергия и образуются
нейтроны деления – мгновенные (10-15 сек) и
запаздывающие (0,114-54,3 сек после деления)
■ Образовавшиеся нейтроны расщепляют др. ядра,
в результате образуется еще больше нейтронов и
идет цепная ядерная реакция, обусловленная
тем, что вместо каждого потерянного в процессе
деления ядер нейтрона образуется в среднем
больше, чем один нейтрон
■ Управлять цепной реакцией можно только
благодаря наличию запаздывающих нейтронов
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
103
104. Ядерный реактор
Ядерный реактор – аппарат, в которомпроисходит управляемый процесс деления
ядер.
Для непрерывного прохождения цепной
ядерной реакции деления надо компенсировать
потери нейтронов – число образующихся при
делении ядер нейтронов должно быть равно
или больше начального количества нейтронов
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
104
105. Принципиальная схема простейшего ядерного реактора (с массой, близкой к критической)
Коэффициентразмножения
K = · f ·n,
где - доля непоглощенных
первичных нейтронов,
f – доля нейтронов от доли, которые
вызвали деление,
n- число новых нейтронов,
образовавшихся при одном делении
К должен быть равен или больше
1 (но немного – до ~1,01), чтобы
шла управляемая цепная
реакция.
Если К=2, то произойдет
атомный взрыв через 10-6 сек
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
105
106. Принципиальная схема гетерогенного ядерного реактора
1 – урановые стержни (ТВЭЛы);2 – замедлитель (с
минимальным P и атомным
весом – графит,Be);
3 – отражатель (из материалов,
подобных замедлителю);
4 – защита;
5 – регулирующий стержень
(с большим P)
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
106
107. Принципиальная схема ТВЭЛа (поперечное сечение)
1 – пруток ядерногогорючего;
2 – внутренняя
оболочка;
3 – внешняя оболочка;
4 – канал для
теплоносителя
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
107
108. УРАН Изотопный состав урана и реакции при захвате нейтронов ядрами 238U
Изотопы урана:234U
238U
(0,006%), 235U (0,712%), 238U (99,28%)
делится только быстрыми нейтронами с большой энергией. При
взаимодействии с тепловыми нейтронами:
+ n 239U92 +
239U 239Np + e
92
93
-1
239Np 239Pu + 0e
93
94
-1
238U
238U
235U
09.02.2017
92
Значительного выделения энергии в этих реакциях не происходит.
является топливным сырьем для получения Pu.
является легко делящимся тепловыми нейтронами изотопом
Курс “Структура и свойства цветных металлов и сплавов“
108
109. Физические, химические свойства и полиморфные превращения в уране
Температура плавления урана 1132 0С.(ОЦК) – модификация U стабильна при охлаждении до 764 775
0С.
-фаза (сложная тетрагональная решетка) – существует в
диапазоне от 7750 665 0С
0
(ромбическая решетка) – ниже 665 С
Переход β →α происходит с сильным уменьшением объема
(плотность увеличивается с 18,1 до 19,1 г/см3), это
вызывает большие внутренние напряжения
Низкая электро – и теплопроводность
(= 30 мкОм см)
■ Высокая химическая активность на воздухе (вплоть до
самовозгорания порошка), в воде и многих др. средах, с
жидкометаллическими теплоносителями взаимодействует слабо
- Природный уран радиационно практически безопасен
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
109
110. Влияние температуры на механические свойства урана, прокатанного в – области с последующим быстрым охлаждением
Влияние температуры на механическиесвойства урана, прокатанного в – области с
последующим быстрым охлаждением
При комнатной т-ре
у чистого (99,95%)
урана σв=300-500
МПа, =4-10%
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
110
111. Изменение формы и размеров U при облучении и ТЦО
09.02.2017Курс “Структура и свойства цветных металлов и сплавов“
111
112. Радиационное повреждение – изменение формы и размеров прутков ядерного горючего, повышение твердости, охрупчивание, образование пор и тр
Радиационное повреждение –изменение формы и размеров прутков ядерного горючего, повышение
твердости, охрупчивание, образование пор и трещин, шероховатость
поверхности
Причины радиационного «роста»:
1) смещение атомов из положений равновесия,
2) внедрение продуктов деления в кристаллическую
решетку,
3) возникновение «термических пиков»,
4) анизотропия кристаллической решетки
Свеллинг – газовое распухание при высоких
температурах (>400 0С) из-за образования при
делении ядер ксенона и криптона
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
112
113. Размерная нестабильность в условиях многократных теплосмен
Наблюдается при наличии сильной текстуры,устранение текстуры устраняет
формоизменение
Чем крупнее зерно, тем меньше рост, но
рельефней получается поверхность
Структурные изменения: рекристаллизация,
полигонизация, образование пор
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
113
114. Зависимость изменения длины уранового стержня от числа циклов нагрева и охлаждения 100 0С 500 0С 1 – после прокатки при 300 0С и отжига при 575 0С;
Зависимость изменения длины уранового стержня от числациклов нагрева и охлаждения 100 0С 500 0С
1 – после прокатки при 300 0С и отжига при 575 0С;
2 – после прокатки при 600 0С и отжига при 575 0С; 3 – после прокатки при 600
0С и закалки из – области
СС
кк
о
р
о
с
т
ь
Скорость
роста падает
С
с ослаблением
к
текстурованности
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
114
115. Сплавы урана
Сплавы с α-структурой –малолегированные (10-2 % Al, Fe, Si),
сплавы с Mo, Zr, Nb (до 10%) – отсутствие
текстуры, мелкое зерно, дисперсные
частицы
Сплавы с γ-структурой (ОЦК) с Mo, Zr, Nb
(более 10%) –уменьшенное
формоизменение, повышенная
пластичность и коррозионная стойкость
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
115
116. Керамическое и дисперсионное ядерное горючее (ЯГ)
Керамическое ЯГ – соединения U и др.радиоактивных металлов с металлоидами (O, C,
N) – получают методами порошковой
металлургии
Дисперсионное ЯГ – это композиты с
дискретными частицами соединений
радиоактивных металлов в нерадиоактивной
матрице (металлической, графитовой или
керамической)
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
116
117. Фазовая диаграмма системы U – Mo
09.02.2017Курс “Структура и свойства цветных металлов и сплавов“
117
118. Фазовая диаграмма системы U – Zr
09.02.2017Курс “Структура и свойства цветных металлов и сплавов“
118
119. Плутоний и его сплавы Полиморфизм плутония
Полиморфныепревращения
в плутонии
Tпп,
0С
Кристаллическая решетка
аллотропических
модификаций Pu
Плотность,
г/см3
472
- ОЦК
16,5
450
- объемноцентрированная
16
тетрагональная
310
- ГЦК
15,9
218
- гранецентрированная
17,1
ромбическая
119
- объемноцентрированная
17,8
моноклинная
- простая моноклинная
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
19,8
119
120. Свойства плутония
■ -Pu – еще более химически активен, чем уран,радиационно опасен из-за - и -излучения,
обладает очень большим КТР и электросопротивлением
(145 мкОм.см);
-предел прочности 350-400 МПа, <1%.
■ -Pu с ГЦК-решеткой пластичен, изотропен по свойствам,
имеет положительный температурный коэффициент
электросопротивления и отрицательный ТКР;
■ большие объемные изменения при полиморфных
превращениях;
■ невозможность использования чистого Pu в ядерных
реакторах.
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
120
121. Салавы плутония
Сплавы Pu c Al (на основе Al – дисперсионное ЯГ – сл.128)Сплавы с переходными металлами (Zr, Ce, Fe)
Сплавы Pu-U, Pu-Th и Pu-U-Mo для реакторов на
быстрых нейтронах
Фиссиум – сплавы U-Pu со смесью продуктов
деления (в основном Mo и Ru)
Сплавы Pu с Fe, Ni, Co с низкой Тпл для
жидкого ядерного горючего
■ Сплавы Pu c Ga – стабилизация -фазы сильно
уменьшает объемные изменения
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
121
122. Температурные зависимости изменения длины Pu и его сплавов с Ga
09.02.2017Курс “Структура и свойства цветных металлов и сплавов“
122
123. Растворимость некоторых добавок в и модификациях Pu
Растворимость некоторых добавок ви модификациях Pu
Фазы
Легирующий
элемент
Алюминий
13 – 16
12
Цинк
6
3–6
Церий
24
14
Торий
4
4–5
Титан
4,5
8
Железо
1,4 – 1,5
3
Цирконий
70 – 72
Полная
Уран
1
Полная
09.02.2017
Влияние легирующего
элемента на нижнюю
границу области
Повышает
Курс “Структура и свойства цветных металлов и сплавов“
123
124. Фазовая диаграмма системы Pu – Al
09.02.2017Курс “Структура и свойства цветных металлов и сплавов“
124
125. Фазовая диаграмма системы Pu – Zr
09.02.2017Курс “Структура и свойства цветных металлов и сплавов“
125
126. Фазовая диаграмма системы Pu – U
09.02.2017Курс “Структура и свойства цветных металлов и сплавов“
126
127. Фазовая диаграмма системы Pu – Fe
09.02.2017Курс “Структура и свойства цветных металлов и сплавов“
127
128. Торий и его сплавы Реакции превращения 232Th в 233U
Торий и его сплавыРеакции превращения
232Th
232Th +
+
n
90
90
233Pa
232Th
в 233U
0e
+
91
-1
233U
92
+e
Т-ра плавления технического Th 1690 0С.
При 1400 0С -Th с ГЦК решеткой переходит в -Th с ОЦК решеткой.
Плотность - Th 11,65 г/см3,
Удельное электросопротивление 20-30 мкОм·см
КТР 11,7 10-6 град-1 – в несколько раз меньше, чем у U
Имеет хорошую пластичность и изотропность свойств благодаря ГЦК
решетке, но малопрочен (HV 40-80)
Высокая жаропрочность
Химическая активность ниже, чем у урана
Используется чаще всего в виде сплавов с ураном при повышенной
концентрации 235U
09.02.2017
Курс “Структура и свойства цветных металлов и сплавов“
128
129. Фазовая диаграмма системы Th – U
09.02.2017Курс “Структура и свойства цветных металлов и сплавов“
Популярное
- Рекламные персонажи Ой, кто это
- Презентация на тему «История возникновения глобуса
- Скачать презентацию по химии на тему кальций
- WMS (системы управления складом): задачи и возможности
- Книга красная шапочка читать онлайн
- Доктор Делового Администрирования в управлении проектами - Doctor of Business Administration (DВА) in Project Management Кто обучается на программе
- Редколлегия - это сердце или мозг издания?
- Системы интегрированной логистической поддержки для наукоемких изделий на постпроизводственных стадиях жизненного цикла Интегрированная логистическая поддержка продукци
- Методика расчёта стоимости жизненного цикла на отдельные узлы, оборудование и комплектующие, поставляемые на ОАО «твз
- Как рассчитать и получить декретные пособия для предпринимателя ип